El agua es una sustancia química formada por dos átomos de hidrógeno y uno de oxígeno, con la fórmula H2O. Es esencial para la vida en la Tierra y se encuentra en estado líquido, sólido (hielo) y gaseoso (vapor de agua).
El agua es fundamental para los procesos biológicos, como la hidratación, el transporte de nutrientes, la regulación de la temperatura corporal y la función de muchos sistemas biológicos. Además, desempeña un papel crucial en la geología y el clima de la Tierra, participando en la erosión, la formación de paisajes y el ciclo del agua, que incluye la evaporación, la condensación, la precipitación y el escurrimiento.
- Ciencia del agua
- Ciclo hidrológico
- Agua segura
Ciencia del agua
Molécula del agua
El agua está compuesta por 1 átomo de oxígeno y 2 de hidrógeno, la fórmula química de este compuesto es H2O. Las moléculas de agua se unen entre si debido una fuerza conocida como puentes de hidrógeno que inclusive provocan su unión con otras sustancias polares.
Existen modelos complejos que buscan explicar y esquematizar las moléculas y átomos de manera realista. Sin embargo, uno de los modelos más didácticos es el establecido por el físico Niels Bohr conocido como “modelo planetario”, el cual se caracteriza por los electrones (partículas con carga negativa) que giran a través de órbitas concéntricas alrededor de un núcleo de protones y neutrones. En la siguiente imagen se muestra una molécula de agua representada por el modelo de Bohr.
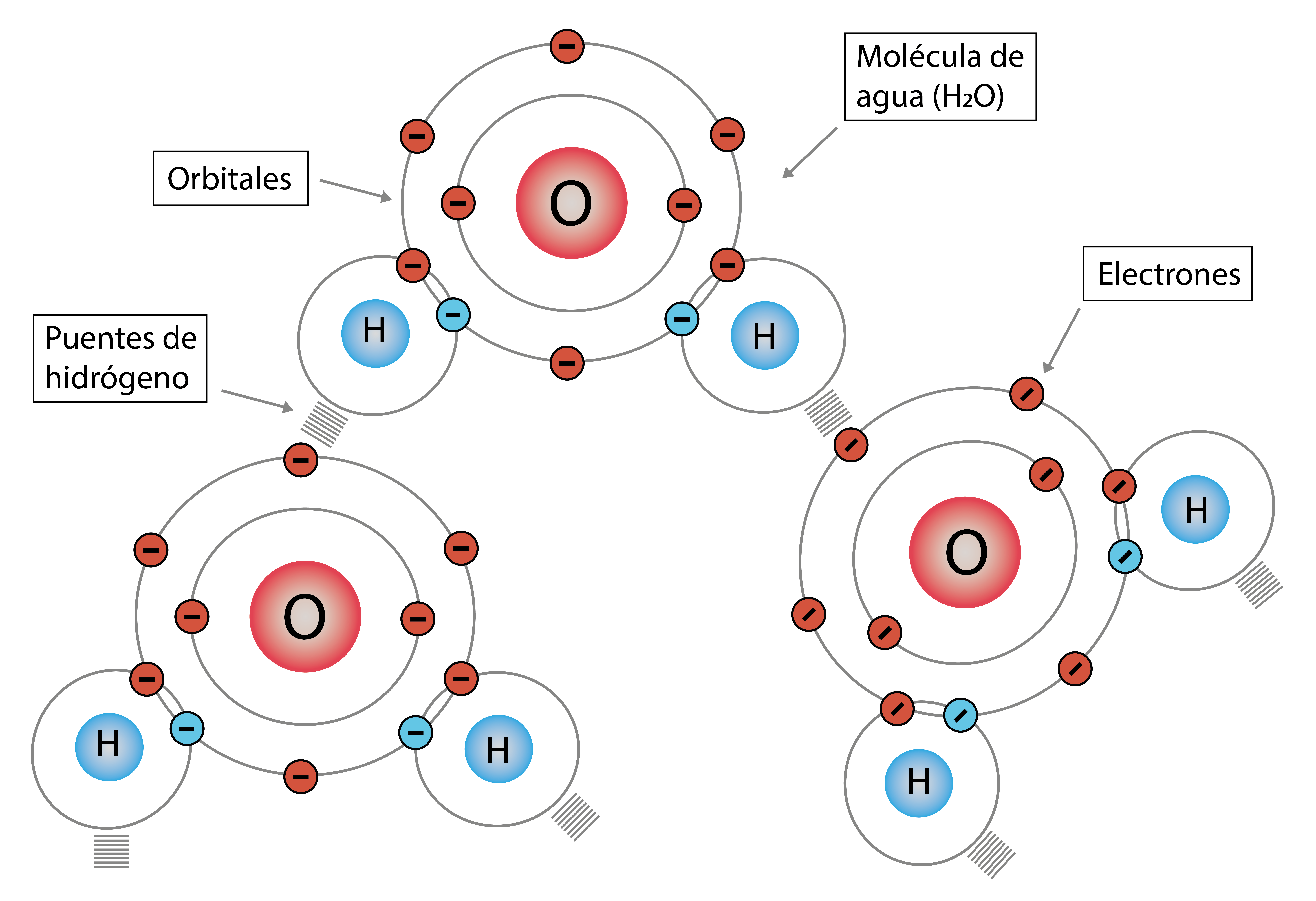
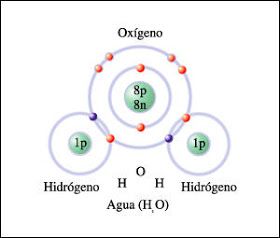
Propiedades fisicoquímicas
El agua es una molécula sumamente abundante en el ambiente que, dependiendo del entorno, puede adoptar cierta coloración, olor y sabor. Sin embargo, en su estado puro es una sustancia que carece de dichos atributos. La particularidad incolora, insípida e inodora, les confiere a todos los sistemas acuáticos la capacidad de sostener la vida de los organismos

Cambio de estado

El agua puede estar presente en la naturaleza en estado sólido, líquido, gaseoso y cambiar entre cada uno de estos estados dependiendo de la temperatura y presión a la que se encuentre expuesto.
Esta propiedad es fundamental en el ciclo del agua debido a que el vapor de agua es transportado hasta el interior de las zonas continentale
Tensión superficial
Este concepto se puede entender como la formación molecular de una capa elástica en la superficie de un líquido. De esta manera, un objeto que no supere las 72 dinas de presión puede permanecer en la superficie sin hundirse, esto pudiera incluir algunos insectos, hojas, polvo y otros materiales ligeros.

Densidad

La densidad consiste en la relación entre la masa y el volumen que ocupa una sustancia. El agua en estado líquido tiene una densidad bastante estable, independientemente de los cambios de temperatura o presión, esta presenta un puede ir de 0.96 a 1 kg por litro a 100°C y 3.8°C respectivamente. Sin embargo, la densidad baja a 0.92 kg por litro cuando el agua pasa a estado sólido, debido a esto, los icebergs flotan en el mar.
Capacidad calorífica
La capacidad calorífica se traduce como la cantidad de energía necesaria para aumentar la temperatura de un líquido o sólido. El agua presenta el valor más alto de esta propiedad con 1 cal/g °C. Esta propiedad es muy importante debido a que los ecosistemas acuáticos mantienen una temperatura adecuada en condiciones de extremo calor o frío. Además, la temperatura de los organismos vivos se regula en gran parte por la fracción de agua contenida en la sangre.

Cohesión

Esta propiedad consiste en la unión molecular del agua por una fuerza conocida como puentes de hidrógeno. Debido a esto, es posible que dos gotas de agua se unan inmediatamente después de entrar en contacto. Sin embargo, existen sustancias conocidas como hidrofóbicas que, molecularmente, repelen el agua.
Adhesión
Se entiende como adhesión a la capacidad que tiene el agua de permanecer aferrada a una superficie inclusive en contra de la fuerza de gravedad. Al igual que la cohesión, esta propiedad se origina por la unión con puentes de hidrógeno.

Anfotera

Esta propiedad se refiere a la capacidad de un líquido para actuar como un ácido o base dependiendo de la reacción química. El agua presenta un pH neutro, lo que resulta en que sea una excelente sustancia amortiguadora.
Se debe mencionar que, en ninguna circunstancia, se debe agregar agua a un reactivo ácido o básico, ya que esto puede provocar una reacción violenta y peligrosa. Por lo que, es mejor añadir el ácido o base en el agua hasta obtener la concentración deseada.
Conductividad eléctrica
Esta propiedad se refiere a la capacidad de transportar una corriente eléctrica en líquidos. En el caso específico del agua, este transporte se ve favorecido por la presencia de iones libres de sodio, calcio, potasio, magnesio, entre otros.
El sodio está presente en la sal común (NaCl), por lo tanto, el agua tiende a aumentar la conductividad eléctrica a medida que esta presenta mayor salinidad.

Capilaridad

Capilaridad
Esta propiedad le confiere a los líquidos la capacidad de ascender, a pesar de la fuerza de gravedad, a través de una superficie sólida debido a sus características adhesión y cohesión. Debido a esto las plantas pueden suministrar agua desde las raíces hasta las hojas a través de vasos conductores.










