Aprendizaje motor y receptores a canabinoides en la corteza del cerebelo
- Inicio
- Comité Editorial
- Lineamientos
- Carta de Cesión de Derechos
- Información Legal
- Acerca de la Revista
- Bases de Datos
- Contacto
- ISSN 2007-3054
- Centro de Investigaciones Cerebrales
Universidad Veracruzana
Artículo de Investigación
Motor learning and cannabinoid receptors at the cerebellar cortex
Jorge Manzo1*, Marta Miquel2, Miguel Pérez-Pouchoulén1, Genaro A. Coria-Ávila1*, Luis I. García1*, Rebeca Toledo1**, María Elena Hernández1**
1Programa de Neurobiología, Universidad Veracruzana, Xalapa, Ver. México. 2Área de Psicobiología, Universitat Jaume I, Castellón, España. *Cuerpo Académico de Neurociencias. **Cuerpo Académico de Neuroquímica
Resumen/Abstract
Introducción
Material y Métodos
Resultados
Discusión
Conclusiones
Agradecimientos
Bibliografía
Correspondencia
Introducción: El cerebelo es una estructura clave para el control del movimiento. Aquí planteamos la pregunta sobre su papel en el aprendizaje y ejecución de la conducta sexual de la rata macho. El estudio se enfocó en las fluctuaciones de receptores a canabinoides, que están directamente implicados en la depresión a largo plazo, uno de los mecanismos neurales del aprendizaje y la memoria.
Objetivos: Determinar la densidad de receptores a canabinoides tipo CB1 en la corteza del vermis cerebelar de ratas macho, durante su entrenamiento para la adquisición de experiencia sexual.
Material y Métodos: Se utilizaron ratas macho Wistar, sin experiencia sexual. Se sometieron a cinco pruebas de entrenamiento, una cada tercer día. Al final de cada prueba, algunas ratas se utilizaron para determinar los niveles del receptor CB1 mediante inmunohistoquímica.
Resultados: El vermis cerebelar presenta una densidad basal de receptores a canabinoides, que muestra una reducción significativa y temporal en los lóbulos 1, 6, 7 y 10. Una vez que el sujeto se vuelve experto, la densidad de los receptores regresa a su nivel basal.
Conclusiones: El aprendizaje de la conducta sexual requiere de la reducción temporal de receptores CB1 en cuatro lóbulos cerebelares. Se propone que esto fortalece conexiones sinápticas a través de mecanismos de depresión y potenciación a largo plazo. Así, la fluctuación de endocanabinoides en estos lóbulos del vermis cerebelar parece indispensable para los procesos de maduración de circuitos neurales que le permiten a un sujeto adquirir la experiencia para la ejecución apropiada de la conducta sexual.
Palabras clave: Depresión a largo plazo; Potenciación a largo plazo; Língula, Nodulus, Conducta sexual.
Introduction: The cerebellum is a key structure for the control of movement. Here, we ask the question about its role in the learning and execution of sexual behavior in the male rat. The study focused on the fluctuation of cannabinoid receptors that are directly involved in the long-term depression, one of the neural mechanisms for learning and memory.
Objective: To determine the density of CB1 type cannabinoid receptor at the cortex of the vermis cerebellum in male rats, during their training to acquire sexual experience.
Materials and Methods: Sexually naive Wistar male rats were used. They received five training sessions, one each other day. At the end of each test, some rats were used to determine the levels of CB1 receptors by immunohistochemistry.
Results: The vermis cerebellum has a basal density of cannabinoid receptors that showed a significant transitory reduction at the lobules 1, 6, 7 and 10. Once the subject became expert, the density returned to basal levels.
Conclusions: The learning of sexual behavior requires the transitory reduction of CB1 receptors in four cerebellar lobules. It is proposed that it strengths synaptic connections through mechanisms of long-term depression and potentiation. Thus, the fluctuation of endocannabinoids at these cerebellar lobules at the vermis seems required for the establishment of neural circuits that allow the subject to get the experience for the appropriate execution of sexual behavior.
Keywords: Long-term depression; Long-term potentiation; Lingula; Nodulus; Sexual behavior.
La estructura corporal de los individuos de cualquier especie animal, incluida la humana, está organizada con diversos sistemas fisiológicos, siendo el sistema nervioso central el encargado de regular a todos los demás. A pesar de esta complejidad, el propósito final del conjunto de sistemas es que el individuo pueda interaccionar con su entorno y con sus conespecíficos, mediante la ejecución de patrones elaborados de posturas y movimientos catalogados históricamente como patrones de conducta,1 cuya base neural incluye de manera importante al cerebelo.
Una de las conductas notables dentro de la organización social de las especies es la conducta sexual. En la rata, esta conducta ha sido muy utilizada para estudiar toda una gama de procesos neuroendocrinos. En el macho se caracteriza por tres grupos de movimientos: la monta, la intromisión y la eyaculación.2 Estos parámetros los ejecuta un macho una vez que su desarrollo lo lleva a ser adulto joven. Sin embargo, los sujetos deben primero aprender la ejecución de sus patrones motores para volverse sexualmente expertos y tener una adecuada reproducción, esto es, del total de ratas macho que alcanzan el estado adulto, existe un alto porcentaje que aprende a ejecutar los movimientos de la cópula, pero existe también un porcentaje que nunca puede reproducirse por no aprender a ejecutar esos movimientos.3 Desde esta perspectiva surge la pregunta sobre el papel del cerebelo no sólo en el control de la ejecución de la conducta sexual, sino en el aprendizaje del patrón motor que lleva a los machos a ser expertos en la ejecución de esta conducta.
Previamente mostramos que el vermis del cerebelo se activa de manera bifásica en machos expertos, esto es, responde de manera intensa a la estimulación sexual y esa respuesta disminuye conforme va pasando la cópula.4 Sin embargo, la situación para un adulto joven es distinta. La primera vez en su vida que un sujeto joven e inexperto se enfrenta con una hembra en estro, presenta movimientos inseguros y desorientados, que al cabo de un tiempo (aproximadamente dos semanas) afina y convierte en patrones de ejecución perfecta.
Estos cambios se reflejan en cambios eléctricos significativos que hemos podido detectar en la corteza del cerebelo.5 No obstante, aún falta por conocer la base neuroquímica de estos cambios durante el aprendizaje de la conducta, lo que constituyó el objetivo central de este trabajo.
Uno de los procesos conocidos para almacenar memoria es la depresión a largo plazo (LTD por sus siglas en inglés), que dentro de la corteza del cerebelo se ha tipificado como un proceso significativo que subyace al aprendizaje de un patrón motor.6 A grandes rasgos, se refiere a la reducción de la potencia sináptica entre la fibra paralela y la neurona de Purkinje. ¿Cuál es el mecanismo por el que se reduce esta efectividad sináptica? Existen varias hipótesis, siendo una de ellas la que propone que hay un aumento en la liberación de endocanabinoides por las dendritas de Purkinje hacia las terminales de las neuronas granulosas. Se sabe que las neuronas de la capa granulosa son glutamatérgicas, por lo que ejercen sinapsis excitatorias sobre las dendritas de las células de Purkinje.7 Y se sabe también que las terminales de estas fibras paralelas tienen en su membrana receptores para moléculas conocidas como endocanabinoides o canabinoides.8
La evidencia reciente ha mostrado que la activación de una dendrita de la célula de Purkinje, por el glutamato liberado de las fibras paralelas, produce la depolarización de la dendrita, que a su vez libera endocanabinoides al espacio sináptico y produce retrógradamente la inhibición de la liberación de más neurotransmisor presináptico. Esto es, la dendrita de Purkinje inhibe a la terminal de la fibra paralela a través de la activación de sus receptores canabinoides, del tipo 1 (CB1).9 Esta comunicación bidireccional se considera como la base de la LTD, que a su vez se entiende como el sistema relevante para el aprendizaje y la coordinación motora del sujeto.10 Así, en este trabajo se planteó la hipótesis de que el sistema de endocanabinoides es crucial para promover el aprendizaje de los patrones motores de la cópula en ratas macho adultas jóvenes.
2.1 Sujetos
Los sujetos experimentales fueron ratas macho de la cepa Wistar, adultas jóvenes (~2 meses de edad) viviendo en un ciclo invertido de luz-oscuridad, cuyo desarrollo desde el destete fue en grupos constituidos únicamente por machos, por lo que llegaron a esta edad sin ningún contacto sexual con hembras. Para las pruebas de entrenamiento sexual, se usaron hembras adultas ovariectomizadas. La inducción de la receptividad sexual de las hembras fue mediante la administración exógena de hormonas esteroides diluidas en aceite vegetal. Así, se les inyectó subcutáneamente a las hembras benzoato de estradiol (10 µg) y progesterona (500 µg) 48 y 4 horas antes de las pruebas de conducta respectivamente. Todas las ratas del experimento se mantuvieron en jaulas de acrílico (50 x 30 x 20 cm; cinco animales del mismo sexo por jaula) que contenía una cama de aserrín, con alimento (Harlan México) y agua disponible todo el tiempo y en un cuarto con temperatura controlada (22 ± 4°C).
Todo el proceso experimental fue realizado bajo los estándares que marca la Norma Oficial Mexicana (NOM-062-ZOO-1999), y apoyada también en las Políticas para el Uso de Animales en la Investigación en Neurociencias de la Society for Neuroscience.
2.2 Entrenamiento de la Conducta Sexual
La interacción sexual de los machos inexpertos con las hembras receptivas se realizó cada tercer día, dos veces por semana durante dos semanas, procedimiento ya estandarizado por diversos autores en la que los machos aprenden la ejecución de la conducta sexual en cuatro pruebas. Aquí se realizó una prueba extra, a fin de tener dos pruebas consecutivas de los machos ya expertos (la cuarta y la quinta). Cada prueba inició con la colocación del macho en el interior de un cilindro de Plexiglass (50 cm de diámetro x 50 cm de alto). Cinco minutos después, se colocó en el cilindro a una hembra receptiva y en ese momento se inició el registro de todos los parámetros de la conducta sexual.11 El final de las pruebas fue marcado por la primera de las siguientes situaciones que sucediera: 1) 20 minutos después de la introducción de la hembra si el macho no ejecutaba ninguna intromisión, 2) 30 minutos después de la primer intromisión si el macho no alcanzaba la eyaculación, o 3) inmediatamente después de la eyaculación del macho. La primera prueba fue iniciada con 10 machos. Al final de la prueba (y en el mismo esquema para las pruebas siguientes), se seleccionaron al azar dos machos que fueron utilizados para el análisis de receptores a canabinoides CB1. De tal manera que ocho machos pasaron a la segunda prueba conductual, seis a la tercera, cuatro a la cuarta y los últimos dos a la quinta. El procedimiento se repitió tres veces, dando así una n=6 en cada uno de los días de prueba.
2.3 Inmunohistoquímica para el Receptor a Canabinoides (CB1)
Después de su respectiva prueba conductual, los animales seleccionados se anestesiaron con una sobredosis de pentobarbital sódico vía i.p. (60mg/Kg). Posteriormente, se llevó a cabo una perfusión transcardial en la que se administró solución salina al 0.9 % heparinizada (500 ml), seguido de paraformaldehído al 4 % (en búfer de fosfato, PB, pH = 7.4; 500 ml) como solución fijadora. Al término de ésta, se procedió a la extracción del cerebelo y su post-fijación por 12 h. Posteriormente el cerebelo se sometió a cambios graduales en solución de sacarosa al 10, 20 y 30 % por 24 h, para su crioprotección. Luego se hicieron cortes sagitales de 20 µm de la región del vermis, utilizando un crióstato (Leyca), y los cortes se almacenaron en PB (0.1 M; 4 °C).
Los cortes del vermis fueron lavados con solución de PB y con solución de PB conteniendo Tritón X-100 (PBT, 0.1 %; Sigma-Aldrich). A continuación, se eliminaron las peroxidasas endógenas del tejido y después se incubó con el anticuerpo primario contra el receptor a canabinoides CB1 a una dilución de 1:5000 (CB1 hecho en conejo; USBiological), y suero normal de cabra al 1 % (Vector Laboratories) en PBT (0.3 %) durante 48 h a 4°C. Posteriormente, el tejido se incubó con el anticuerpo secundario (suero anti-conejo hecho en cabra, Vector Laboratories; 1:250) en PBT 0.3 % por 2 h en agitación constante y a temperatura ambiente. Pasado dicho tiempo, se procedió a la incubación con el complejo avidina-biotina (0.9 % avidin and 0.9 % biotin; Kit ABC Ellite-Estándar, Vector Laboratories; 1:200) en PB por 90 min en agitación constante y a temperatura ambiente. El revelado inmunohistoquímico se hizo en PB utilizando diamino-benzidina (Kit DAB, Vector Laboratories) a una concentración de 0.02 mg/20 ml, solución de níquel a una concentración de 0.2 mg/20 ml y peróxido de hidrógeno al 30 %, dejándose reaccionar durante 15 min. Finalmente, los cortes fueron montados sobre portaobjetos gelatinizados (2 %), deshidratados y cubiertos con Permount para su posterior análisis microscópico. Los cortes control fueron procesados de igual manera pero sin el anticuerpo primario.
2.4 Fotomicrografía y Análisis
Las imágenes digitales de las preparaciones fueron obtenidas utilizando un microscopio Olympus Provis AX70, que mediante una cámara enviaba la señal a un sistema de cómputo, donde era capturada y procesada con el programa Image-Pro Plus (Media Cibernetics, Inc). Las imágenes fueron grabadas en escala de grises a 8 bits, y fueron procesadas para determinar la concentración de receptores CB1 por densitometría. Considerando que regiones más oscuras representan mayor densidad de receptores, el valor original que resultó de la densitometría de la escala de grises fue transformada con la operación matemática de números recíprocos (1/x) a fin de facilitar la interpretación de las gráficas. La densitometría se realizó en cuatro zonas (~1,600 µ2 cada una) de cada lóbulo de la corteza cerebelar: la Capa Molecular Distal, la Capa Molecular Proximal, la Capa de Purkinje y la Capa de la Granulosa (Fig. 1). Los datos fueron analizados con un Análisis de Varianza seguido por la prueba post-hoc de Tukey cuando el valor F resultó significativo (p<0.05).
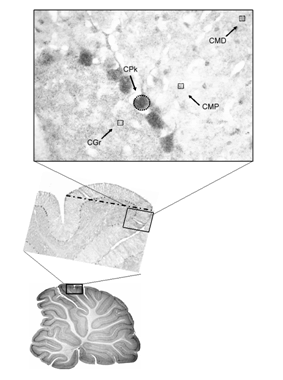
Figura 1. Corte sagital (fotografía inferior) de la región media del vermis del cerebelo de una rata macho. El primer recuadro muestra una amplificación del lóbulo 6 (fotografía media), que a su vez amplifica la corteza cerebelar (fotografía superior). La densitometría de receptores a canabinoides CB1 se realizó en la mita distal de la capa molecular (CMD), en la mitad proximal de la capa molecular (CMP), en la capa de las células de Purkinje (CPk) y en la capa de la granulosa (CGr).
Los datos indican que las cuatro zonas de la corteza del cerebelo analizadas, presentaron una densidad equivalente de receptores a canabinoides CB1. Sin embargo, la región distal de la Capa Molecular presentó una diferencia significativa entre lóbulos, dado que los lóbulos 1 y 10 exhibieron una cantidad significativamente mayor que el resto [F(9,49)= 10.58, p<0.01], (Fig. 2).
El entrenamiento de la conducta sexual no modificó en su gran parte los niveles de receptores a canabinoides CB1. No obstante, nuevamente en la región distal de la Capa Molecular se observaron reducciones significativas en la densidad de receptores en el lóbulo 1 [F(4,24)=43.29, p<0.01], lóbulo 6 [F(4,24)=65.25, p<0.01], lóbulo 7 [F(4,24)=31.13, p<0.01], y lóbulo 10 [F(4,24)=69.84, p<0.01], (Fig. 3).
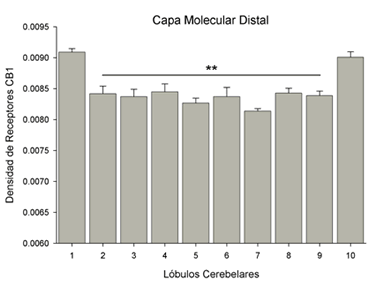
Figura 2. Cuantificación de la densidad de receptores a canabinoides CB1 en la mitad distal de la capa molecular de ratas macho sexualmente inexpertas. La figura muestra que todos los lóbulos presentan una densidad basal, con los lóbulos 1 y 10 mostrando la mayor densidad, por lo que los lóbulos del 2 al 9 presentan una cantidad significativamente menor (** = p<0.01).
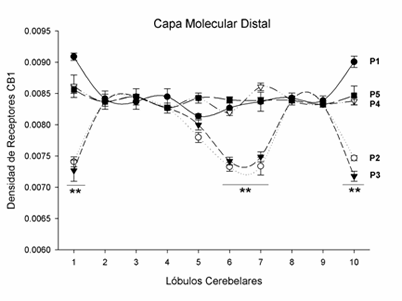
Figura 3. Fluctuación en la densidad de receptores a canabinoides CB1 en la mitad distal de la capa molecular durante las cinco pruebas de conducta sexual (P1 A P5). La gráfica muestra que los lóbulos 1, 6, 7 y 10 muestran una reducción significativa de la densidad después de la segunda (P2) y tercer (P3) pruebas conductuales (** = p<0.01). Las dos últimas pruebas de conducta (P4 y P5), donde ya se ha alcanzado la experiencia sexual, muestran que los niveles vuelven a estados basales.
Las reducciones no fueron en todas las pruebas de conducta, se presentaron solamente en la segunda y tercer prueba conductual, y a partir de la cuarta prueba los niveles volvieron a su estado basal.
La conjunción de lo ocurrido en los lóbulos 6 y 7 da otra muestra de esta disminución temporal de la densidad de receptores CB1 (Fig. 4).
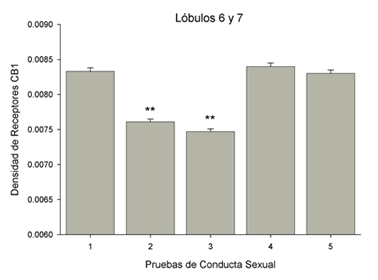
Figura 4. Fluctuación en la densidad de receptores a canabinoides CB1 en la mitad distal de la capa molecular de los lóbulos 6 y 7 durante las cinco pruebas de conducta sexual. Las barras muestran el decremento significativo y transitorio de los receptores (** = p<0.01) en sólo dos pruebas de entrenamiento, lo que indica la caída en el nivel de receptores durante el entrenamiento y el regreso a niveles basales una vez alcanzada la experiencia sexual.
La corteza del vermis cerebelar de ratas macho que llegan a estado adulto tiene una densidad basal de receptores a canabinoides CB1 en todos los lóbulos y en las tres capas de cada uno. Este hecho era de esperarse dado que ya se había reportado la existencia en el cerebelo de altos niveles de anandamida, que es el neurotransmisor de tipo lipídico que se acopla a los receptores CB1.12 A pesar de ello, aquí se observó que la densidad basal en la mitad distal de la capa molecular de los lóbulos 1 y 10, conocidos también como língula y nodulus respectivamente, es mayor que la del resto de los lóbulos. El común denominador de estos dos lóbulos es que ambos están flanqueados por los pedúnculos cerebelares y están bañados casi de manera directa por el líquido cefalorraquídeo del cuarto ventrículo,13 lo que pudiera darles una mayor integración funcional de lo que podría deducirse. La língula, o lóbulo 1, ha sido relacionada desde hace tiempo con el control de la cola en mamíferos, como ratas y algunos primates, en donde su postura tiene funciones conductuales específicas,13, 14 mientras que el nodulus, o lóbulo 10, está relacionado con procesos visuales y vestibulares fundamentales para el equilibrio y la dirección de los movimientos.15, 16
El entrenamiento que lleva al macho a ser sexualmente experto produce una respuesta transitoria en la mitad distal de la capa molecular en la língula y el nodulus, así como en los lóbulos 6 y 7. Durante la adquisición de la habilidad motora, el nivel de los receptores a canabinoides CB1 disminuye significativa-mente en estos cuatro lóbulos, subiendo nuevamente a niveles basales una vez que el sujeto ha alcanzado la experiencia sexual. La reducción transitoria en la densidad de receptores CB1 implica que esa fibra paralela está menos expuesta al proceso de la LTD, lo cual llevaría a una situación inversa del estado eléctrico de esas sinapsis conocidas como potenciación a largo plazo o LTP.17 Este complejo heterosináptico que lleva a una regulación bidireccional (LTD-LTP) de las sinapsis entre las fibras paralelas y las neuronas de Purkinje, parece otorgar una mayor plasticidad a la corteza cerebelar para la adquisición, almacenamiento y refinamiento de patrones motores,18, 19 y el mecanismo es más probable considerando que los receptores CB1 en la corteza del cerebelo están asociados directamente a la fibras paralelas de las neuronas granulosas.20
La reducción que se observa en la densidad de receptores CB1 pareciera ser el resultado de un mecanismo que lleva a su regulación a la baja, disparado por la primera experiencia sexual del sujeto y observado hasta la segunda prueba conductual. La regulación a la baja de este tipo de receptores se ha observado en situaciones de estrés,21 lo que permite sugerir que otras situaciones sociales, como el entrenamiento sexual, pudieran también disparar mecanismos para la reducción de la densidad de estos receptores. Previamente mostramos que la amplitud eléctrica de la actividad multiunitaria de la capa granulosa se reduce en los lóbulos 6 y 7 durante el aprendizaje de la conducta sexual, pero ya no se reduce en sujetos expertos.5 Con ello, sugerimos que en adición a la reducción del número de neuronas de la granulosa activas durante el aprendizaje de la conducta sexual, parece existir de manera simultánea una regulación a la baja de los receptores CB1 que pudiera producirse en las mismas o en otras neuronas granulares. Así, considerando como ejemplo una sola neurona de Purkinje, podemos sugerir que el aprendizaje motor de la conducta sexual no sólo se basa en el mecanismo de la LTD en una parte de su árbol dendrítico, sino en un efecto sinérgico entre la LTD, la reducción en la actividad eléctrica de algunas neuronas granulares y la reducción a la baja de receptores CB1 en fibras paralelas que hagan sinapsis sobre distintas zonas del mismo árbol dendrítico, activando procesos de LTP. Pero considerando un grupo de neuronas de Purkinje, estos procesos simultáneos podrían suceder en neuronas distintas, lo que produciría un balance de excitación/inhibición para el control fino de los núcleos profundos. Este complejo bioeléctrico sobre el extenso árbol dendrítico de la neurona de Purkinje, fortalecería el propósito final de los cuatro lóbulos que respondieron al entrenamiento sexual, que es mediar procesos de aprendizaje motor mediante la inhibición sináptica entre algunas fibras paralelas y neuronas de Purkinje, pero con la activación simultánea de otras distintas.
Los cuatro lóbulos en donde se observaron cambios en la densidad de receptores CB1, son los que hemos encontrado constantemente como parte de lo que hemos denominado el cerebelo sexual, debido a su activación en diversos paradigmas experimentales relacionados con el aprendizaje o ejecución de la cópula.4, 5 Sin embargo, el nuevo hallazgo en este estudio es que la modificación de los receptores CB1 se da fundamentalmente en la mitad distal de la capa molecular. Esta observación es relevante, dado que se sabe que el árbol dendrítico de las neuronas de Purkinje tiene dos grandes dominios, el dominio proximal que corresponde a las ramificaciones gruesas con muy baja densidad de espinas dendríticas, y el dominio distal que son las ramificaciones delgadas que contienen grandes concentraciones de espinas dendríticas y que son los lugares donde hacen sinapsis las fibras paralelas.22 El dominio distal es el que se encuentra mayormente concentrado en la mitad distal de la capa molecular, por lo que es el lugar en donde se concentran el mayor número de sinapsis entre las fibras paralelas y las neuronas de Purkinje. Con ello, se refuerza la propuesta de que los cambios detectados en la concentración de receptores CB1, corresponden a aquellos que se encuentran en las fibras paralelas.
Un dato relevante es que una vez alcanzada la experiencia sexual, los niveles reducidos de los receptores CB1 de los cuatro lóbulos donde se observó modificación, volvieron a elevarse hasta llegar y mantenerse en los niveles basales mostrados por el resto de los lóbulos. Este hecho sugiere que la temporalidad en el decremento de los receptores es necesaria para una reestructuración sináptica que permita madurar al circuito que lleva a la experiencia sexual, cuya activación posterior parece que ya no depende de la modulación de los receptores CB1. La propuesta puede apoyarse con un correlato de lo que ocurre con el sistema olfatorio y la experiencia sexual. Se ha demostrado que el aprendizaje de la conducta sexual en ratas macho es alterado si se les produce una lesión de las vías olfatorias cuando son inexpertos, pero que esta lesión no tiene ningún efecto en machos que ya son expertos sexualmente.23 Esto indica que el sistema olfatorio es fundamental para el aprendizaje de la cópula, pero no para su mantenimiento una vez que es aprendida. Considerando los cuatro lóbulos donde se redujo la densidad de receptores CB1 y que el lóbulo 7 tiene un papel preponderante en el circuito olfatorio,24 la propuesta es que estos lóbulos cerebelares pudieran estar involucrados en procesos que construyen circuitos neurales que subyacen a una conducta, mediante la modificación temporal de sus contenidos moleculares.
La corteza del cerebelo en la región del vermis presenta una densidad basal de receptores a canabinoides del tipo CB1. Estos receptores se mantienen estables en la mayoría de los lóbulos durante el aprendizaje de los patrones motores de la conducta sexual en ratas macho. Sin embargo, los lóbulos 1, 6, 7 y 10 muestran una reducción significativa y temporal durante el proceso de aprendizaje conductual. Una vez que el sujeto se vuelve experto, la densidad de los receptores regresa a su nivel basal. A partir de aquí, se concluye que el aprendizaje motor de la conducta sexual requiere de la remoción temporal de estos receptores, probablemente con el propósito de fortalecer conexiones sinápticas a través de mecanismos de depresión y potenciación a largo plazo. Con ello, se propone que la fluctuación de endocanabinoides en estas regiones específicas del vermis cerebelar es indispensable para los procesos de maduración de circuitos neurales que le permiten a un sujeto adquirir la experiencia requerida para la ejecución apropiada de la conducta sexual.
Beca de la Secretaria General de Universidades del Ministerio de Educación, España SAB2009-0159 (JM); Programa de Incorporación de Investigadores Españoles en Universidades Mexicanas AECI 2008 (MM); Beca Conacyt 210236 (MPP); Donativo PROMEP/103.5/07/2753 (PTC-195; LIG); Proyecto CONACYT 106531 (MEH).
- Tinbergen N. The study of instinct. Oxford University Press, London. 1951.
- Meisel RL, Sachs BD. The physiology of male sexual behavior. En: Knobil E, Neill JD, (Eds.). The physiology of reproduction. New York: Raven Press. 1994 pp. 3-105.
- Portillo W, Paredes RG. Sexual and olfactory preference in noncopulating male rats. Physiol Behav 2003 80:155-162.
- Manzo J, Miquel M, Toledo R, Mayor-Mar JA, Garcia LI, Aranda-Abreu GE et al. Fos expression at the cerebellum following non-contact arousal and mating behavior in male rats. Physiol Behav 2008 93:357-363.
- Garcia-Martinez R, Miquel M, Garcia LI, Coria-Avila GA, Perez CA, Aranda-Abreu GE et al. Multiunit recording of the cerebellar cortex, inferior olive, and fastigial nucleus during copulation in naive and sexually experienced male rats. Cerebellum 2010 9:96-102.
- Ito M. The molecular organization of cerebellar long-term depression. Nat Rev Neurosci 2002 3:896-902.
- Atluri PP, Regehr WG. Delayed release of neurotransmitter from cerebellar granule cells. J Neurosci 1998 18:8214-8227.
- Vallano ML, Beaman-Hall CM, Bui CJ, Middleton FA. Depolarization and Ca(2+) down regulate CB1 receptors and CB1-mediated signaling in cerebellar granule neurons. Neuropharmacology 2006 50:651-660.
- Safo PK, Regehr WG. Endocannabinoids control the induction of cerebellar LTD. Neuron 2005 48:647-659.
- Boyden ES, Katoh A, Raymond JL. Cerebellum-dependent learning: the role of multiple plasticity mechanisms. Annu Rev Neurosci 2004 27:581-609.
- Manzo J, Vazquez MI, Cruz MR, Hernandez ME, Carrillo P, Pacheco P. Fertility ratio in male rats: effects after denervation of two pelvic floor muscles. Physiol Behav 2000 68:611-618.
- Felder CC, Nielsen A, Briley EM, Palkovits M, Priller J, Axelrod J et al. Isolation and measurement of the endogenous cannabinoid receptor agonist, anandamide, in brain and peripheral tissues of human and rat. FEBS Lett 1996 393:231-235.
- Larsell O. The morphogenesis and adult pattern of the lobules and fissures of the cerebellum of the white rat. J Comp Neurol 1952 97:281-356.
- Chang HT, Ruch TC. The projection of the caudal segments of the spinal cord to the lingula in the spider monkey. J Anat 1949 83:303-7, pl.
- Akaike T. Lobular distribution of visual climbing fiber responses in the cerebellum. Brain Res 1985 327:359-361.
- Sharp FR. Rotation induced increases of glucose uptake in rat vestibular nuclei and vestibulocerebellum. Brain Res 1976 110:141-151.
- Hartell NA. Parallel fiber plasticity. Cerebellum 2002 1:3-18.
- Coesmans M, Weber JT, De Zeeuw CI, Hansel C. Bidirectional parallel fiber plasticity in the cerebellum under climbing fiber control. Neuron 2004 44:691-700.
- Jorntell H, Hansel C. Synaptic memories upside down: bidirectional plasticity at cerebellar parallel fiber-Purkinje cell synapses. Neuron 2006 52:227-238.
- Kawamura Y, Fukaya M, Maejima T, Yoshida T, Miura E, Watanabe M et al. The CB1 cannabinoid receptor is the major cannabinoid receptor at excitatory presynaptic sites in the hippocampus and cerebellum. J Neurosci 2006 26:2991-3001.
- Reich CG, Taylor ME, McCarthy MM. Differential effects of chronic unpredictable stress on hippocampal CB1 receptors in male and female rats. Behav Brain Res 2009 203:264-269.
- Cesa R, Strata P. Axonal competition in the synaptic wiring of the cerebellar cortex during development and in the mature cerebellum. Neuroscience 2009 162:624-632.
- Thor DH, Flannelly KJ. Social-olfactory experience and initiation of copulation in the virgin male rat. Physiol Behav 1977 19:411-417.
- Manzo J, Ortíz-Pulido R, Pérez CA, Toledo R, García LI, Hernández ME. Alteration of sexual-related sensory and motor processes after the lesion of cerebellar lobules in male rats. 2009 Neuroscience Meeting Planner 772.5. 2009. Chicago, IL, Society for Neuroscience.
| Recibido: 7 de junio de 2010 | Aceptado: 28 de junio de 2010 |
Correspondencia:
Dr. Jorge Manzo, Programa de Neurobiología, Universidad Veracruzana, Xalapa, Ver., Tel.: (228) 841-8900 Ext. 13607, Correo:jmanzo@uv.mx
Este es un artículo de libre acceso distribuido bajo los términos de la licencia de Creative Commons, (http://creativecommons.org/licenses/by-nc/3.0), que permite el uso no comercial, distribución y reproducción en algún medio, siempre que la obra original sea debidamente citada.

