Evaluación de la actividad termorreguladora y cardiovascular durante el sueño
- Inicio
- Comité Editorial
- Lineamientos
- Carta de Cesión de Derechos
- Información Legal
- Acerca de la Revista
- Bases de Datos
- Contacto
- ISSN 2007-3054
- Centro de Investigaciones Cerebrales
Universidad Veracruzana
Erik Leonardo Mateos Salgado1*, Fructuoso Ayala Guerrero1, Benjamín Domínguez Trejo1
1Facultad de Psicología, Universidad Nacional Autónoma de México.
Resumen
Abstract
Introducción
Materiales y métodos
Resultados
Discusión
Conclusión
Conflicto de intereses
Agradecimientos
Referencias
Mail
La actividad termorreguladora y cardiovascular presentan ritmicidad circadiana asociada con el ciclo vigilia-sueño. El uso de la polisomnografía (PSG) ha facilitado el estudio de la temperatura corporal y actividad cardiovascular tanto durante el sueño con movimientos oculares rápidos (MOR) como del sueño sin MOR (NMOR). Sin embargo, existen pocos estudios que han evaluado la temperatura corporal y actividad cardiovascular a lo largo de los ciclos NMOR-MOR. El objetivo de este estudio fue evaluar las características de la temperatura periférica y variabilidad de la frecuencia cardiaca durante los ciclos NMOR-MOR. Se realizaron estudios de PSG en 15 participantes sanos donde se analizaron la temperatura periférica, la arritmia sinusal respiratoria (ASR) y la frecuencia baja (FB). Los análisis estadísticos muestran que en la temperatura periférica hubo diferencias significativas entre las diferentes fases de sueño, mientras que los valores de la ASR y la FB variaron significativamente tanto entre las diferentes fases de sueño como entre los ciclos NMOR-MOR. Se ha descrito que la respuesta termorreguladora es diferente entre el sueño NMOR y MOR, en este estudio se observaron diferencias significativas en la temperatura periférica entre las fases de sueño N2, N3 y MOR. Estos resultados resaltan diferencias en los mecanismos reguladores de la temperatura y de la actividad cardiovascular cuando se considera la ciclicidad del sueño NMOR y MOR.
Palabras clave: Temperatura periférica, Variabilidad de la frecuencia cardiaca, Sistema nervioso autónomo, Ritmos biológicos.
Thermoregulatory and cardiovascular activity show circadian rhythmicity associated with the wake-sleep cycle. The use of polysomnography (PSG) has facilitated the study of body temperature and cardiovascular activity during both rapid eye movement (REM) and non-REM (NREM) sleep. However, few studies have evaluated body temperature and cardiovascular activity throughout the NREM-REM cycles. This study aimed to evaluate the characteristics of peripheral temperature and heart rate variability during NREM-REM cycles. PSG studies were performed in 15 healthy participants where peripheral temperature, respiratory sinus arrhythmia (RSA), and low frequency (LF) were analyzed. Statistical analyses show that in peripheral temperature there were significant differences between the different sleep stages, while RSA and LF values varied significantly both between sleep stages and between NREM-REM cycles. The thermoregulatory response has been described to be different between NREM and REM sleep, in this study, significant differences in peripheral temperature were observed between N2, N3, and REM sleep stages. These results highlight differences in the regulatory mechanisms of temperature and cardiovascular activity when considering the cyclicity of NREM and REM sleep.
Keywords: Peripheral temperature, Heart rate variability, Autonomic nervous system, Biological rhythms.
La actividad termorreguladora en humanos mantiene la temperatura corporal dentro de un rango específico esencial para el funcionamiento celular.1 La temperatura corporal se puede dividir en central y periférica, el sistema nervioso autónomo (SNA) mediante la regulación del flujo sanguíneo de la piel influye en la temperatura periférica.2 Con mayor flujo sanguíneo de la piel se incrementa la temperatura de la piel lo que facilita la pérdida de calor.3 La temperatura corporal varía a lo largo del tiempo, al registrar continuamente por varios días la temperatura central y periférica se observa que presentan un ritmo circadiano que está sincronizado con el ciclo vigilia-sueño.4 De manera general el sueño ocurre durante la fase circadiana tanto de menor producción como de mayor pérdida de calor.5
La incorporación del registro de polisomnografía (PSG) en la evaluación de la temperatura corporal permite asociar el patrón de oscilación de la temperatura corporal con el sueño sin movimientos oculares rápidos (NMOR) y sueño con movimientos oculares rápidos (MOR).4 Con el uso de la PSG se ha identificado que previo al inicio del sueño NMOR la temperatura periférica incrementa;7 que existe un ritmo circadiano endógeno de propensión al sueño MOR que está acoplado al ritmo de la temperatura corporal;8 y que la temperatura periférica difiere entre las fases de sueño.9 El sueño se puede caracterizar por la presencia de un ritmo ultradiano asociado con la ciclicidad del sueño NMOR y MOR.10 No obstante, la relación de este ritmo ultradiano con la temperatura corporal solo se ha analizado en un estudio.11
También, la actividad cardiovascular presenta variaciones de tipo circadiano.12 El análisis de la variabilidad de la frecuencia cardiaca (VFC) permite evaluar la regulación autonómica de la actividad cardiovascular. Con este análisis, se puede evaluar el patrón circadiano de la actividad parasimpática cardiaca.13 Además, con la VFC se pueden identificar diferencias entre las fases del sueño, durante el sueño NMOR hay predominancia de actividad parasimpática y disminución de la simpática, mientras que en el sueño MOR hay predominancia de actividad simpática y reducción de la actividad parasimpática.14-15 15 Solo en un estudio se ha evaluado la relación de los ciclos NMOR-MOR del sueño con la VFC.16
La caracterización del sueño en ciclos NMOR-MOR se basa principalmente en la actividad cerebral que permite diferenciar las fases de sueño. Sin embargo, no están bien establecidos los patrones de actividad termorreguladora y de la VFC durante estos ciclos. Por lo que no es claro si el ritmo ultradiano del ciclo NMOR-MOR se puede caracterizar con base en la temperatura corporal y la VFC. El objetivo de este estudio fue evaluar las características de la temperatura periférica y algunas medidas de la VFC durante los ciclos NMOR-MOR del sueño.
2.1. Participantes
Participaron hombres y mujeres sanos mayores de 18 años. Los criterios de inclusión fueron que los participantes no presentaran diagnóstico médico de alguna enfermedad crónica ni de trastornos mentales. Asimismo, se excluyeron a participantes que fumaran o consumieran alguna droga ilegal o estuvieran ingiriendo algún medicamento que afectara los estados de vigilancia. El estudio se llevó a cabo en 15 voluntarios (ocho mujeres), cuya edad promedio fue de 24.7 años con desviación estándar (DE) de 4.3. A todos los participantes se les proporcionó información sobre el procedimiento de la investigación y posteriormente firmaron carta de consentimiento informado. Además, los procedimientos de evaluación se realizaron de acuerdo con los principios básicos establecidos en la Declaración de Helsinki.
2.2. Procedimiento
Se realizaron dos registros de PSG en noches consecutivas. En las mujeres los registros se llevaron a cabo entre el quinto y décimo día de su ciclo menstrual para evitar los posibles efectos de la ovulación y del incremento de temperatura presente durante la fase lútea del ciclo menstrual.17,18 La primera PSG se consideró como registro de adaptación a las condiciones del estudio y sirvió para detectar la presencia de algún trastorno del sueño y en este caso, excluir al participante. En la segunda PSG se registraron las derivaciones F4, F3, C4, C3, O2 y O1 del electroencefalograma (EEG) con referencias contralaterales al mastoides derecho e izquierdo respectivamente, además del electrooculograma, electromiograma de superficie del músculo mentoniano y el electrocardiograma (ECG). Los registros de PSG se realizaron con un equipo Easy II (Cadwell, USA). El inicio de cada PSG (luces apagadas) se ajustó para cada participante de acuerdo con su horario habitual para ir a dormir, registrándose durante ocho horas aproximadamente. La clasificación de las fases de sueño se realizó de acuerdo con el método de la Academia Americana de Medicina del Sueño (AASM, por sus siglas en inglés) en épocas de sueño de 30 segundos.19 Para este estudio solo se consideraron los datos obtenidos a partir de la segunda PSG de los participantes que no presentaron indicadores de trastornos del sueño en el registro de adaptación.
Se consideraron para análisis, muestras de temperatura periférica y del ECG pertenecientes a las fases N2 y MOR de cuatro ciclos NMOR-MOR. Como la fase N3 es escasa en el tercer y cuarto ciclo NMOR-MOR,10 las muestras de temperatura periférica y del ECG de esta fase se tomaron del primer y segundo ciclo NMOR-MOR. Las muestras seleccionadas estuvieron libres de artefactos por movimiento o microdespertares. También, se descartaron muestras pertenecientes a la transición entre fases de sueño, para lo cual en cada transición se omitieron datos de 5 minutos entre dos fases de sueño diferentes, 2.5 minutos de una fase sueño y 2.5 minutos de la otra fase.
2.3. Evaluación de la temperatura periférica
La temperatura se registró mediante termosensores iButton Thermochron modelo DS1921H (Maxim Integrated, USA) con una resolución de .125°C. Para programar cada iButton se usó el software OneWireViewer, la frecuencia de muestreo se estableció en una muestra de temperatura por cada minuto. Los iButton se colocaron en la parte anterior de las muñecas derecha e izquierda y se fijaron mediante gasa adhesiva y elástica marca Hypafix (BSN medical). De cada iButton se puede obtener información sobre la fecha y hora de cada dato de temperatura registrado, la hora depende del reloj interno de la computadora en la que se instala el software OneWireViewer. Para asociar cada valor de temperatura con una época calificada de sueño, el software OneWireViewer se instaló en la misma computadora del equipo de PSG a fin de que tuvieran el mismo reloj interno. Así, cada valor de temperatura se asignó a una época de sueño considerando la coincidencia del tiempo. La temperatura periférica se obtuvo del promedio de las temperaturas de ambas muñecas.
2.4. Evaluación de la variabilidad de la frecuencia cardiaca
Del ECG se obtuvieron los intervalos entre latidos cardiacos (ILC) mediante el software QRSTool versión 1.2.2.20 Posteriormente, los ILC se analizaron con el software CardioBatch Plus (Brain-Body Center for Psychophysiology and Bioengineering, University of North Carolina), la arritmia sinusal respiratoria (ASR) en la banda de .12-.4 Hz y la frecuencia baja (FB) en la banda de .06-.1 Hz. Estas dos medidas se calcularon cada 30 segundos para poder asociarlas con las épocas de sueño que tenían valores de temperatura asignados.
2.5. Análisis estadísticos
Debido a que algunas variables fisiológicas evaluadas no tuvieron distribución normal y considerando el tamaño de la muestra, se optó por usar pruebas no paramétricas.
La comparación entre los cuatro ciclos NMOR-MOR se realizó con la prueba de Friedman y solo se analizaron las fases N2 y MOR. En el caso de resultados estadísticamente significativos, se realizaron análisis post hoc con la prueba de los rangos con signo de Wilcoxon entre los pares correspondientes a los cuatro ciclos NMOR-MOR. Además, con la prueba de los rangos con signo de Wilcoxon se compararon el primer y segundo ciclo NMOR-MOR de la fase N3. El nivel de significancia se estableció en p<.05, para los análisis post hoc este nivel se ajustó considerando el número de comparaciones por pares realizadas.
Adicionalmente, en los resultados significativos obtenidos con la prueba de los rangos con signo de Wilcoxon se calculó un valor aproximado del tamaño del efecto (r),21 que se obtuvo al dividir el valor Z entre la raíz cuadrada de N, donde N representó el número de observaciones de las dos fases de sueño o de los dos ciclos NMOR-MOR comparados. Con este método, r=.1 representa un efecto pequeño, r=.3 representa un efecto mediano y r=.5 representa un efecto grande.21
El promedio del tiempo total de sueño evaluado fue de 445 (DE=25) minutos y de la eficiencia de sueño fue de 96% (DE=2). Mientras que los promedios de los porcentajes de las fases de sueño fueron 7% (DE=3) de la fase N1, 56% (DE=7) de la fase N2, 16% (DE=6) de la fase N3, y 21% (DE=4) del sueño MOR.
3.1. Comparación entre las fases N2, N3 y MOR del sueño de cada uno de los ciclos
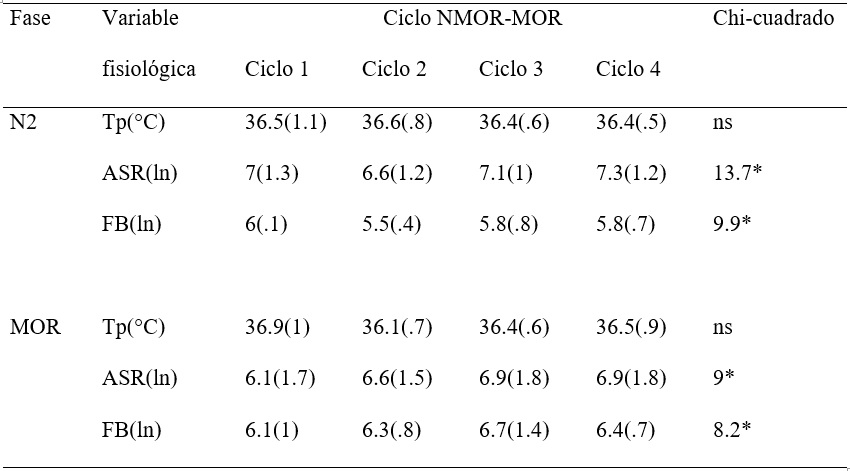
En la temperatura periférica hubo diferencias significativas entre las fases de sueño en el primer y segundo ciclo NMOR-MOR. En el primer ciclo NMOR-MOR la temperatura fue ligeramente mayor en el sueño MOR, aunque en los análisis post hoc se identificó que solo entre las fases N2 y N3 hubo diferencias significativas con un tamaño del efecto grande (r=.6). En el segundo ciclo NMOR-MOR la temperatura fue menor en el sueño MOR, con los análisis post hoc se identificó que la temperatura del sueño MOR fue significativamente menor a la temperatura de la fase N2 con un tamaño del efecto grande (r=.6), asimismo el sueño MOR fue significativamente menor a la temperatura de la fase N3 con un tamaño del efecto mediano (r=.4) (Tabla 1).
En las medidas de la VFC, la FB tuvo diferencias significativas entre las fases de sueño en ambos ciclos NMOR-MOR con medianas mayores en el sueño MOR. En los análisis post hoc del primer ciclo NMOR-MOR solo hubo diferencia significativa en la comparación de la fase N2 con la fase N3 con un tamaño del efecto grande (r=.6). En los análisis post hoc del segundo ciclo NMOR-MOR las diferencias significativas en la FB estuvieron entre el sueño MOR y la fase N2 con un tamaño del efecto grande (r=.6) y entre el sueño MOR y la fase N3 con un tamaño del efecto grande (r=.5). La medida de ASR tuvo diferencias significativas entre las fases de sueño solo en el primer ciclo NMOR-MOR, con la mediana de ASR menor en el sueño MOR. En los análisis post hoc ASR mostró diferencias significativas solo entre el sueño MOR y la fase N3 con tamaño del efecto mediano (r=.4) (Tabla 1).
Tabla 1. Comparación entre las fases de sueño. Mediana (rango intercuartil). Cc= Chi-cuadrado, ns= no significativo * significativo en p<.05, ** significativo en p<.017, Tp= temperatura periférica, ASR= arritmia sinusal respiratoria, FB= frecuencia baja, ln=logaritmo natural.
En la comparación entre las fases N2 y MOR del tercer y cuarto ciclo NMOR-MOR, en la temperatura periférica no se encontraron diferencias significativas. En el tercer ciclo NMOR-MOR las diferencias significativas entre las fases N2 y MOR se tuvieron solo en la FB con un tamaño del efecto mediano (Z=-2.4, p=.017, r=.4). Mientras que en el cuarto ciclo NMOR-MOR se tuvieron diferencias significativas con tamaños del efecto medianos en la FB (Z=-2.2, p=.028, r=.4) y ASR (Z=-2.2, p=.028, r=.4).
3.2. Comparación entre los diferentes ciclos NMOR-MOR
En la comparación de la fase N2 entre los cuatro ciclos NMOR-MOR se observó que en la temperatura periférica no hubo diferencias significativas, permaneciendo en niveles similares durante el transcurso de la noche (Tabla 2). En tanto que, en las dos medidas de la VFC, si se presentaron diferencias significativas y la ASR tuvo la mediana mayor en el cuarto ciclo NMOR-MOR, mientras que en la FB los valores de la mediana fueron mayores durante el primer ciclo NMOR-MOR. Los análisis post hoc indicaron que la FB tuvo diferencia significativa con un tamaño del efecto grande cuando se comparan el segundo ciclo NMOR-MOR con el tercero (Z=-2.7, p=.007, r=.5).
En la comparación del sueño MOR entre los cuatro ciclos NMOR-MOR en la temperatura periférica no hubo diferencias significativas (Tabla 2). Mientras que en las dos medidas de la VFC si se obtuvieron diferencias significativas, observándose que los valores mayores de las medianas de la FB estuvieron en el tercer ciclo NMOR-MOR y para la ASR en el tercer y cuarto ciclo. Los análisis post hoc indicaron que hubo diferencias significativas en la ASR cuando se comparan el sueño MOR del primer ciclo NMOR-MOR con el segundo con un tamaño del efecto grande (Z=-2.9, p=.003, r=.5) y el sueño MOR del primer ciclo NMOR-MOR con el cuarto con un tamaño del efecto grande (Z=-2.9, p=.003, r=.5). Asimismo, la FB mostró diferencias significativas tanto al comparar el sueño MOR del primer ciclo NMOR-MOR con el segundo con un tamaño del efecto grande (Z=-2.7, p=.007, r=.5), como el sueño MOR del primer ciclo con el cuarto con un tamaño del efecto mediano (Z=-2.4, p=.006, r=.4). Finalmente, en la comparación de la fase N3 entre el primer y segundo ciclo NMOR-MOR no se encontraron diferencias significativas en la temperatura periférica y en las medidas de la VFC.
Tabla 2. Comparación entre los cuatro ciclos NMOR-MOR del sueño. Mediana (rango intercuartil), ns= no significativo, * significativo en p<.05, Tp= temperatura periférica, ASR= arritmia sinusal respiratoria, FB= frecuencia baja, ln= logaritmo natural.
Los valores de los porcentajes de tiempo invertido por los participantes en cada fase de sueño, así como los de su eficiencia del sueño estuvieron dentro de los rangos considerados normales.10 Por otra parte, la respuesta termorreguladora es diferente entre el sueño NMOR y MOR, con menor temperatura en el sueño MOR,22 lo cual se relaciona con la mayor actividad simpática presente en este sueño.23 Aunque esta diferencia es menos pronunciada en humanos comparados con otros mamíferos.6 En este estudio encontramos que la temperatura periférica difiere entre las fases de sueño N2, N3 y MOR de los primeros dos ciclos NMOR-MOR. En los análisis post hoc, solamente la fase N3 tuvo diferencias significativas con las otras fases de sueño en ambos ciclos NMOR-MOR, lo que sugiere que esta fase contribuye con la diferenciación de la respuesta termorreguladora.
Además, durante el sueño MOR la regulación de la temperatura está ausente,22,24,25 con tal ausencia de los mecanismos reguladores de la temperatura los mamíferos se comportarían como animales poiquilotermos.26 Sin embargo, los estudios que sustentan la falta de regulación de la temperatura en el sueño MOR se han realizado principalmente en mamíferos no humanos.5,6,27 En este estudio encontramos que la temperatura periférica del sueño MOR fue significativamente menor a las fases N2 y N3 del sueño NMOR solo en el segundo ciclo NMOR-MOR. Además, al comparar los cuatros ciclos NMOR-MOR encontramos que la temperatura periférica fue mayor en el sueño MOR del primer ciclo NMOR-MOR comparado con los tres ciclos restantes, aunque estas diferencias no alcanzaron significancia estadística.
Durante el sueño se presenta la fase circadiana de mayor flujo sanguíneo de la piel,7 que se refleja en mayor temperatura periférica, que favorece el papel de la piel como una barrera natural en la defensa del huésped.5 Durante las primeras horas de sueño la temperatura central disminuye rápidamente lo cual se refleja en mayor temperatura periférica,28 este incremento está relacionado con el cambio de posición corporal de pie a supina que induce la redistribución del calor,29 coincide que en este periodo de tiempo se presenta el primer y segundo ciclo NMOR-MOR. En este estudio se encontró que el nivel de temperatura periférica se mantiene sin cambios significativos entre los cuatro ciclos NMOR-MOR del sueño, además los valores de temperatura estuvieron alrededor de los 36°C que es muy superior a la temperatura diurna habitual e incluso a la termoneutralidad.5,30
El organismo humano es homeotermo, por lo que es capaz de regular la temperatura corporal dentro de ciertos límites cuando se presenta un desajuste, a través de mecanismos termorreguladores en los que participa el SNA.31 Además, en los organismos homeotermos la regulación de la temperatura está fuertemente influenciada por el medio ambiente.32 Aunque en este estudio no se controló la temperatura de la habitación durante el transcurso de la noche, todos los participantes usaron ropa de dormir y cobija por lo que se pudo crear un microclima,7 el cual durante el sueño es de alrededor de 34-36°C. Con la presencia del microclima los participantes permanecieron en un ambiente de temperatura estable, lo que pudo contribuir a mantener el nivel de temperatura periférica sin cambios en los últimos ciclos NMOR-MOR.
Con las medidas de ASR y FB se encontraron diferencias significativas entre las fases del sueño, lo cual se ha reportado previamente.15,33 Al segmentar el sueño en ciclos NMOR-MOR se lograron identificar dos patrones en las diferencias entre las fases de sueño, un patrón presente en el primer ciclo NMOR-MOR en el que las dos medidas de la VFC tuvieron diferencias significativas. En el otro patrón, presente en el segundo ciclo NMOR-MOR, solo la medida FB tuvo diferencias significativas. En relación con la medida ASR, la presencia de diferencias significativas solo en el primer ciclo NMOR-MOR coincide con un estudio previo,34 aunque en ese estudio se evaluó a la banda de frecuencia alta (FA) del espectro de poder de la VFC. No obstante, se considera que tanto ASR como FA son medidas que reflejan actividad parasimpática.35 En este estudio, en lugar de la FA se optó por usar a la medida ASR calculada con el método de Porges-Bohrer, ya que este método elimina tendencias complejas, de baja frecuencia y no respiratorias de la señal de los ILC: además no viola el supuesto de estacionariedad.36
Con la VFC se ha identificado que la actividad parasimpática presenta un ritmo circadiano asociado al ciclo vigilia-sueño,13,33 en este estudio en las medidas de ASR y FB se encontraron diferencias significativas entre los cuatro ciclos NMOR-MOR. En el sueño MOR, ambas medidas mostraron la tendencia de incrementar del primer al último ciclo NMOR-MOR, estos resultados coinciden con un estudio previo.16 En relación con la medida de la FB se considera que proporciona información sobre mecanismos de control parasimpático, regulación del tono vasomotor y de la actividad de barorreceptores.37
Una limitación de este estudio fue el tamaño pequeño de la muestra, por lo que es posible que existan diferencias significativas en la temperatura periférica entre los ciclos NMOR-MOR. Incluso con la muestra pequeña, con la prueba de los rangos con signo de Wilcoxon se obtuvieron resultados significativos con tamaños del efecto de medianos a grandes. Sin embargo, es necesario que próximos estudios se realicen con muestras más grandes para que se puedan corroborar o descartar los hallazgos de este estudio. Asimismo, para la evaluación de la temperatura periférica se podrían evaluar más regiones del cuerpo, lo que permitiría identificar gradientes térmicos.38
En este estudio encontramos que, en la temperatura periférica, la ASR y FB tienen un comportamiento parecido cuando se comparan las fases de sueño N2, N3 y MOR. Cuando estas variables se comparan considerando los ciclos NMOR-MOR tienen un comportamiento distinto. Por lo cual la ritmicidad ultradiana asociada a los ciclos NMOR-MOR influiría de forma distinta en la actividad termorreguladora y en la VFC. También, en el proceso del inicio del sueño la temperatura periférica y la VFC tienen un comportamiento distinto.39 Considerando los resultados obtenidos con las dos medidas de la VFC, la actividad parasimpática además del ritmo circadiano asociado al ciclo vigilia-sueño también presentaría un ritmo ultradiano asociado con la ciclicidad del sueño NMOR y MOR.
Los autores declaran no tener conflicto de intereses.
Los autores declaran no tener conflicto de intereses.
1. Gilbert SS, van den Heuvel CJ, Ferguson SA, Dawson D. Thermoregulation as a sleep signaling system. Sleep Med Rev 2004 8: 81-93.
2. Kräuchi K, Cajochen C, Wirz-Justice A. Thermophysiologic aspects of the three-process-model of sleepiness regulation. Clin Sports Med 2005 24: 287-300.
3. Van den Heuvel CJ, Ferguson SA, Gilbert SS, Dawson D. Thermoregulation in normal sleep and insomnia: the role of peripheral heat loss and new applications for digital thermal infrared imaging (DITI). J Therm Biol 2004 29: 457-61.
4. Mekjavic IB, Eiken O. Contribution of thermal and nonthermal factors to the regulation of body temperature in humans. J Appl Physiol 2006 100: 2065-72.
5. Van Someren EJW. Mechanisms and functions of coupling between sleep and temperature rhythms. Prog Brain Res 2006 153: 309-24.
6. Bach V, Telliez F, Libert JP. The interaction between sleep and thermoregulation in adults and neonates. Sleep Med Rev 2002 6: 481-92.
7. Raymann RJ, Swaab DF, Van Someren EJ. Skin temperature and sleep-onset latency: changes with age and insomnia. Physiol Behav, 2007 90: 257-66.
8. Czeisler CA, Zimmerman JC, Ronda JM, Moore-Ede MC, Weitzman ED. Timing of REM is coupled to the circadian rhythm of body temperature in man. Sleep 1980 2: 329-46.
9. Ortiz-Tudela E, Martinez-Nicolas A, Albares J, Segarra F, Campos M, Estivill E, Rol MA, Madrid J. Ambulatory circadian monitoring (ACM) based on thermometry motor activity and body position (TAP): a comparison with polysomnography. Physiol Behav 2014 126: 30-8.
10. Carskadon MA, Dement WC. Normal human sleep: An overview. En: Kryger MH, Roth T and Dement WC, Principles and practice of sleep medicine. Elsevier 2017 15-24.
11. Burgess HJ, Holmes AL, Dawson D. The relationship between slow-wave activity, body temperature, and cardiac activity during nighttime sleep. Sleep 2001 24: 343-49.
12. Crnko S, Du Pré BC, Sluijter JPG, Van Laake LW. Circadian rhythms and the molecular clock in cardiovascular biology and disease. Nat Rev Cardiol 2019 16: 437–47.
13. Boudreau P, Yeh WH, Dumont GA, Boivin DB. Circadian variation of heart rate variability across sleep stages. Sleep 2013 36: 1919-28
14. Stein PK, Yachuan P. Heart rate variability, sleep and sleep disorders. Sleep Med Rev 2012 16: 47-66.
15. Tobaldini E, Nobili L, Strada S, Casali KR, Braghiroli A, Montano N. Heart rate variability in normal and pathological sleep. Front Physiol 2013 4: 294.
16. Versace F, Mozzato M, De Min Tona G, Caballero C, Stegagno L. Heart rate variability during sleep as a function of the sleep cycle. Biol Psychol 2003 63: 149-62.
17. Baker FC, Siboza F, Fuller A. Temperature regulation in women: effects of the menstrual cycle. Temperature 2020 7: 226-62.
18. Maijala A, Kinnunen H, Koskimäki H, Jämsä T, Kangas M. Nocturnal finger skin temperature in menstrual cycle tracking: ambulatory pilot study using a wearable Oura ring. BMC Womens Health 2019 19: 150.
19. Iber C, Ancoli-Israel S, Chesson AL, Quan SF. The AASM manual for the scoring of sleep and associated events: rules, terminology, and technical specifications. American Academy of Sleep Medicine, Illinois. 2007.
20. Allen JJB, Chambers AS, Towers DN. The many metrics of cardiac chronotropy: A pragmatic primer and a brief comparison of metrics. Biol Psychol 2007 74: 243-62.
21. Pallant, J. SPSS survival manual: a step by step guide to data analysis using IBM SPSS.: Open University Press/McGraw-Hill, Maidenhead. 2016.
22. Parmeggiani PL. Thermoregulation and sleep. Front Biosci 2003 8: s557-67.
23. Zoccoli G, Amici R. Sleep and autonomic nervous system. Curr Opin Physiol 2020 15: 128-33.
24. Cerri M, Luppi M, Tupone D, Zamboni, Amici R. REM sleep and endothermy: potential sites and mechanism of a reciprocal interference. Front Physiol 2017 8: 624.
25. Parmeggiani PL. Influence of the temperature signal on sleep in mammals. Biol Signals Recept 2000 9: 279-82.
26. Affanni JM, Lisogorsky E, Scaravilli AM. Sleep in the giant South American armadillo Priodontes giganteus (Edentata, Mammalia). Experientia 1972 28: 1046–1047.
27. Sagot JC, Amoros V, Candas V, Libert JP. Sweating responses and body temperature during nocturnal sleep in humans. Am J Physiol 1987 252: R462-70.
28. Wehr TA. A brain-warming function for REM sleep. Neurosci Biobehav Rev 1992 16: 379-97.
29. Krauchi K, Deboer T. The interrelationship between sleep regulation and thermoregulation. Front Biosci 2010 15: 604-25.
30. Pallubinsky H, Schellen L, van Marken Lichtenbelt WD. Exploring the human thermoneutral zone – A dynamic approach. J Therm Biol 2019 79: 199-208
31. Johnson JM, Kellog DLJr. Thermoregulatory and thermal control in the human cutaneous circulation. Front Biosci 2010 2: 825-53.
32. Brocas J, Fromageot C. Thermoregulation in homeotherms: central temperature results from optimization of energy transfers. Biol Cybern 1996 74: 225-34.
33. Trinder J, Waloszek J, Woods ML, Jordan AS. Sleep and cardiovascular regulation. Pflugers Arch 2012 463: 161-8.
34. Burgess HJ, Penev PD, Schneider R, Van Cauter E. Estimating cardiac autonomic activity during sleep: impedance cardiography, spectral analysis, and Poincaré plots. Clin Neurophysiol 2004 115: 19-28.
35. Laborde S, Mosley LS, Thayer JF. Heart rate variability and cardiac vagal tone in psychophysiological research. Recommendations for experiment planning, data analysis, and data reporting. Front Psychol 2017 8: 213.
36. Lewis GF, Furman SA, McCool MF, Porges SW. Statistical strategies to quantify respiratory sinus arrhythmia: are commonly used metrics equivalent? Biol Psychol 2012 89: 349-64.
37. Reyes del Paso G, Langewitz W, Mulder LJM, Van Roon A, Duschek S. The utility of low frequency heart rate variability as an index of sympathetic cardiac tone: A review with emphasis on a reanalysis of previous studies. Psychophysiology. 2013 50: 477-87.
38. Taylor NAS, Tipton MJ, Kenny GP. Considerations for the measurement of core, skin and mean body temperatures. J Therm Biol 2014 46: 72-101.
39. Anders D, Gompper B, Kräuchi K. A two-night comparison in the sleep laboratory as a tool to challenge the relationship between sleep initiation, cardiophysiological and thermoregulatory changes in women with difficulties initiating sleep and thermal discomfort. Physiol Behav 2013 114-115: 77-82.
| Recibido: 02 de febrero, 2022 | Aceptado: 18 de marzo, 2022 |
*Correspondencia: Erik L. Mateos Salgado. Laboratorio de Neurociencias, Facultad de Psicología, Av. Universidad 3004, Coyoacán, 04510, Ciudad de México, México. Teléfono: 5556222222, Ext. 41243. E-mail: eriklms@comunidad.unam.mx
Este es un artículo de libre acceso distribuido bajo los términos de la licencia de Creative Commons, (http://creamasal@unam.mxtivecommons.org/licenses/by-nc/3.0), que permite el uso no comercial, distribución y reproducción en algún medio, siempre que la obra original sea debidamente citada.