Alteraciones gastrointestinales en el autismo: Una revisión
- Inicio
- Comité Editorial
- Lineamientos
- Carta de Cesión de Derechos
- Información Legal
- Acerca de la Revista
- Bases de Datos
- Contacto
- ISSN 2007-3054
- Centro de Investigaciones Cerebrales
Universidad Veracruzana
1Flower de MJ Caycho-Salazar, 2Deissy Herrera-Covarrubias, 2María Rebeca Toledo-Cárdenas, 2María Elena Hernández-Aguilar, 2Genaro A. Coria-Ávila, 2Luis I. García, 3Darwin Gutierrez-Guevara, 1Bernardo Flores- Prieto, 2Jorge Manzo-Denes
1Doctorado en Investigaciones Cerebrales, Universidad Veracruzana, Veracruz, México. 2Instituto de Investigaciones Cerebrales, Universidad Veracruzana, Veracruz, México. 3Doctorado en Ciencia del Comportamiento, Universidad Veracruzana, Veracruz, México
Resumen
Abstract
Introducción
Metodología
Resultados
Discusión
Conclusión
Conflicto de intereses
Agradecimientos
Referencias
Correspondencia
El autismo, actualmente denominado trastorno del espectro autista (TEA), se define como una altera-ción del neurodesarrollo caracterizado por dificultades a nivel conductual y socio-comunicativo. Se ha reportado que el TEA presenta una comorbilidad con alteraciones gastrointestinales (GI). Los objetivos de esta revisión fueron tres y estuvieron enfocados en explorar la evidencia de personas con TEA que hayan reportado presentar alteraciones GI, analizar la relación entre el TEA y la composición de la micro-biota intestinal, así como la relación entre las intervenciones enfocadas a modificar síntomas GI y algu-nos comportamientos asociados al TEA. Para ello, fueron analizados artículos de los últimos cinco años. La revisión fue realizada siguiendo las pautas PRISMA-P de investigaciones en humanos encontradas en PubMed y ScienceDirect, incluyendo finalmente 13 artículos: 11 estudios empíricos y 2 de tipo metaaná-lisis. Los resultados arrojaron que las personas con TEA presentan alteraciones GI más frecuentes como estreñimiento y diarrea, evidenciando así una relación entre alteraciones GI y TEA. Sobre la relación del TEA y la composición de la microbiota intestinal se reportó una heterogeneidad en la presencia de gru-pos de bacterias en cohortes con autismo y que presentan una composición disbiótica de la microbiota intestinal. Finalmente, se encontraron intervenciones enfocadas en mejorar síntomas GI y comporta-mientos disruptivos, como el trasplante fecal y la administración de dietas con probióticos.
Palabras clave: Autism, gastrointestinal alterations, intestinal microbiota, fecal transplantation, probiotics
Autism, currently called autism spectrum disorder (ASD), is defined as a neurodevelopmental disorder characterized by behavioral and socio-communicative difficulties. It has been reported that ASD pre-sents comorbidity with gastrointestinal (GI) disorders. The objectives of this review were three and fo-cused on exploring the evidence of people with ASD who have reported presenting GI alterations, ana-lyzing the relationship between ASD and the composition of the intestinal microbiota, as well as the relationship between interventions focused on modifying symptoms. GI and some behaviors associated with ASD. For this, articles from the last five years were analyzed. The review was carried out following the PRISMA-P guidelines for human research found in PubMed and ScienceDirect, finally including 13 articles: 11 empirical studies and 2 meta-analysis types. The results showed that people with ASD pre-sent more frequent GI disorders such as constipation and diarrhea, thus evidencing a relationship be-tween GI disorders and ASD. Regarding the relationship between ASD and the composition of the intes-tinal microbiota, heterogeneity was reported in the presence of groups of bacteria in cohorts with au-tism that present a dysbiotic composition of the intestinal microbiota. Finally, interventions focused on improving GI symptoms and disruptive behaviors were found, such as fecal transplantation and the ad-ministration of diets with probiotics.
Keywords: Autism, gastrointestinal alterations, intestinal microbiota, fecal transplantation, probiotics.
1. Introducción
De acuerdo con la versión número cinco del Manual Diagnóstico y Estadístico de los Trastornos Mentales (“DSM-5”) que publica la Asociación Americana de Psiquiatría, el autismo o el trastorno del espectro autista (TEA), es un trastorno neurobiológico del desarrollo caracterizado por un déficit en las habilidades para la interacción social y la comunicación, así como por la presencia de comportamientos, intereses o actividades estereotipadas.1 Las causas de este trastorno no se encuentran esclarecidas en su totalidad, pero las evidencias apuntan a factores de corte genético,2,3molecular,4 ambiental5 o farmacológico.6-8 Asimismo, se ha reportado comorbilidad con otros trastornos, tales como disrupciones del sueño, ansiedad, epilepsia, alteraciones de tipo gastrointestinal,9 entre otras.
Con relación a las alteraciones gastrointestinales (GI), cada vez es más frecuente el reporte de las familias y pacientes con TEA que presentan este tipo de alteraciones. La prevalencia varía según la literatura, oscilando entre el 30.5%10 al 80%.11 En un estudio se reportó que los niños con TEA tenían al menos tres veces más probabilidades de experimentar síntomas GI recurrentes en comparación con los niños de desarrollo neurotípico, tales como: dolor abdominal, dolor al momento de la defecación, estreñimiento, gases, diarrea y dificultad para pasar ciertos alimentos.12 La presencia de estos síntomas o alteraciones GI en personas con TEA ha sido asociada con mutaciones genéticas11 o alteraciones a nivel de interacción intestino-cerebro.10 En el primer caso, se reportó una mutación disruptiva del gen CHD8 (chromodomain helicase DNA-binding protein 8, por sus siglas en inglés) que cuando se encuentra mutado, hay una mayor presencia de alteraciones gastrointestinales, es decir, episodios frecuentes de estreñimiento seguidos de diarrea.11 Mientras que las alteraciones de interacción intestino-cerebro se presentan como trastornos GI funcionales, es decir, alteraciones a nivel de inmunidad, niveles de producción de mucosa, entre otros, pero que no se deben a un trastorno anatómico; siendo los trastornos más frecuentes el estreñimiento, seguido de diarrea funcional y reflujo.10 De esta manera, la literatura asocia que las personas con TEA presentan síntomas GI con más frecuencia, tales como diarrea, estreñimiento, flatulencias,9-13 etc. Esta asociación encuentra respaldo en la propuesta de que las alteraciones GI que presentan las personas con TEA pueden estar relacionadas a un microbioma disbiótico. Donde, la participación de la vía conocida como el eje microbiota-intestino-cerebro se puede encontrar alterada. Este eje es entendido como una interconexión o vía bidireccional de regulación inmune, neuroendocrina, con el sistema nervioso central (SNC), el sistema nervioso entérico (SNE) y la microbiota intestinal.14,15 Por microbiota se entiende aquel grupo de microorganismos que colonizan el cuerpo humano, como bacterias, hongos, arqueas, etc.16 Estos microorganismos pueden estar alojados en diversas partes del cuerpo y según su ubicación cobran su nombre. Por ejemplo, si se encuentra en la boca se le conoce como microbiota oral; si está en el intestino, microbiota intestinal. La microbiota disbiótica no es más que una microbiota desequilibrada, es decir, una alteración en la composición o función de estos microorganismos. Ha sido propuesto que la interacción intestino-cerebro-microbiota contribuye al desarrollo de trastornos neurológicos,16 psiquiátricos17 y del neurodesarrollo como el TEA.18
Las alteraciones en los procesos metabólicos de las bacterias intestinales pueden ejercer efecto tanto en los órganos de la periferia como en las estructuras del SNC. Es en este eje, microbiota-intestino-cerebro, que a través de la comunicación que realiza el nervio vago con la microbiota intestinal y el cerebro, dicha microbiota puede llegar a afectar la función cerebral en la neuromodulación de tipo serotoninérgica, dopaminérgica, glutamatérgica y GABAérgica,19 así como por neuroinflamación.20
En el caso de las personas con TEA se ha reportado una relación entre las manifestaciones, como las estereotipias, así como alteraciones GI frecuentes con un microbioma menos diverso o disbiótico. Se han encontrado niveles bajos de bacterias consideradas “benéficas” como las Bifidobacterium,21 y una mayor abundancia de hongos y bacterias secretoras de toxinas, Candida y Clostridium, respectivamente.22,23 Asimismo, la integridad de la barrera epitelial intestinal también se ve afectada, ya que se vuelve más permeable24 debido a la generación de metabolitos, como las toxinas. Estas toxinas pueden traspasar la barrera intestinal y llegar a la sangre, con el potencial de afectar funciones cerebrales y deteriorar algunos aspectos comportamentales sociales.25 Incluso, se ha reportado una asociación entre la exacerbación de comportamientos estereotipados26 con la disbiosis de la microbiota intestinal.
Con la premisa de la modulación de este eje microbiota-intestino-cerebro se pueden encontrar respuestas para ver qué tratamientos pueden mejorar síntomas o alteraciones GI, incluidos algunos comportamientos estereotipados, para lo cual han sido propuestas varias líneas terapéuticas como la ingesta de probióticos, prebióticos, dieta baja en FODMAP(acrónimo de Fermentable Oligosaccharides, Disaccharides, Monosaccharides, and Polyols), así como el trasplante de microbiota fecal (fecal microbiota transplantation, FMT) y la terapia de transferencia de microbiota ( Microbiota Transfer Therapy, MTT).27 Particularmente, la dieta FODMAP es rica en oligosacáridos, disacáridos, monosacáridos de baja fermentación y, al ser carbohidratos de cadena corta suelen ser de difícil absorción por el intestino delgado.
La modulación del eje microbiota-intestino-cerebro es un campo de investigación en constante crecimiento, al cual se le está prestando cada vez más atención debido a su relación con otras condiciones de salud, incluido el TEA. Es por tanto que, en esta revisión se abordó evaluar la relación del TEA con las alteraciones GI, para lo cual planteamos tres objetivos. El primero de ellos fue analizar la evidencia de los últimos cinco años en estudios con seres humanos diagnosticados con TEA, y que hayan reportado síntomas o alteraciones GI. El segundo objetivo fue ver la relación entre el autismo y la composición de la microbiota intestinal. Finalmente, el tercer objetivo fue el de hallar la relación entre las intervenciones que apuntan a modificar algunos comportamientos asociados al TEA (tales como estereotipias, irritabilidad) o mejorar síntomas GI, según la composición de la microbiota intestinal.
2. Metodología: criterios de elegibilidad
Se realizó una búsqueda de artículos publicados que aborden la relación del TEA con las alteraciones GI. Se siguieron los lineamientos de PRISMA-P para la correcta revisión. A continuación, se detalla el procedimiento en sus distintas etapas.
2.1. Búsqueda inicial
Las búsquedas fueron realizadas en julio de 2022, combinando términos ‘gastrointestinal diseases’ y ‘autism’, posteriormente se amplió la búsqueda usando el operador booleano “AND” en las bases de datos PubMed (NIH) y ScienceDirect, tomando en cuenta estudios realizados en humanos. Posteriormente se añadió a la búsqueda “gastrointestinal symptons”, “autism spectrum disorder”. Todo ello en un rango de cinco años, es decir, investigaciones entre el 2018 y 2022. La fórmula de búsqueda quedó como: (“AUTISM” OR “ASD” OR “AUTISM SPECTRUM DISORDER”) AND (“GASTROINTESTINAL DISEASES” OR “GASTROINTESTINAL SYMPTOMS” OR “GASTROINTESTINAL PROBLEMS”).
2.2. Búsqueda sistemática
La búsqueda sistemática fue realizada nuevamente hasta el 25 de enero del 2023, tomando en cuenta publicaciones en un rango de cinco años, es decir, entre 2018-2022 en las bases de datos PubMed y ScienceDirect. Las palabras claves utilizadas fueron en inglés: “autism”, “autism spectrum disorder”, “gastrointestinal diseases”, “gastrointestinal symptons”.
Obtuvimos un total de 98 artículos, 14 resultados en PubMed y 84 en ScienceDirect. Antes de proceder a la selección de artículos definimos los criterios de inclusión y de exclusión.
2.3. Criterios de inclusión
Se tomaron en cuenta todos los documentos que hicieron referencia directa a las palabras claves de la fórmula de búsqueda.
• Ensayos clínicos, metaanálisis, ensayos controlados aleatorizados.
• De libre acceso.
• Investigaciones empíricas con humanos.
• Publicaciones en un rango de 5 años, entre 2018-2022.
2.4. Criterios de exclusión
• Artículos de revisión sistemática ni capítulos de libros.
• Los estudios realizados con muestras no humanas.
• Artículos que estuvieran duplicados.
• Artículos que hayan sido de caso único.
• Artículos no pertinentes.
Según estos criterios y la búsqueda realizada con la lectura del título y del resumen fueron consideraros 98 artículos, descartando 85 artículos por las siguientes razones: sin acceso al texto completo (n=3), artículos de revisión (n=6), estudios de caso único (n=2), estudios realizados en modelos animales (n=6), estudios en población con trastornos diferentes al TEA y no pertinentes al propósito de esta revisión (n=68). Finalmente, 13 artículos cumplieron con los criterios de inclusión y fueron seleccionados para realizar la revisión sistemática (Figura 1).
2.5. Población de estudio
La población de estudio fue considerada según el número total de artículos que contenían las palabras clave de búsqueda en ambas bases de datos utilizadas.
2.6. Muestra
Fue determinada de acuerdo con los artículos que cumplieron con todos los criterios de inclusión, teniendo 13 artículos.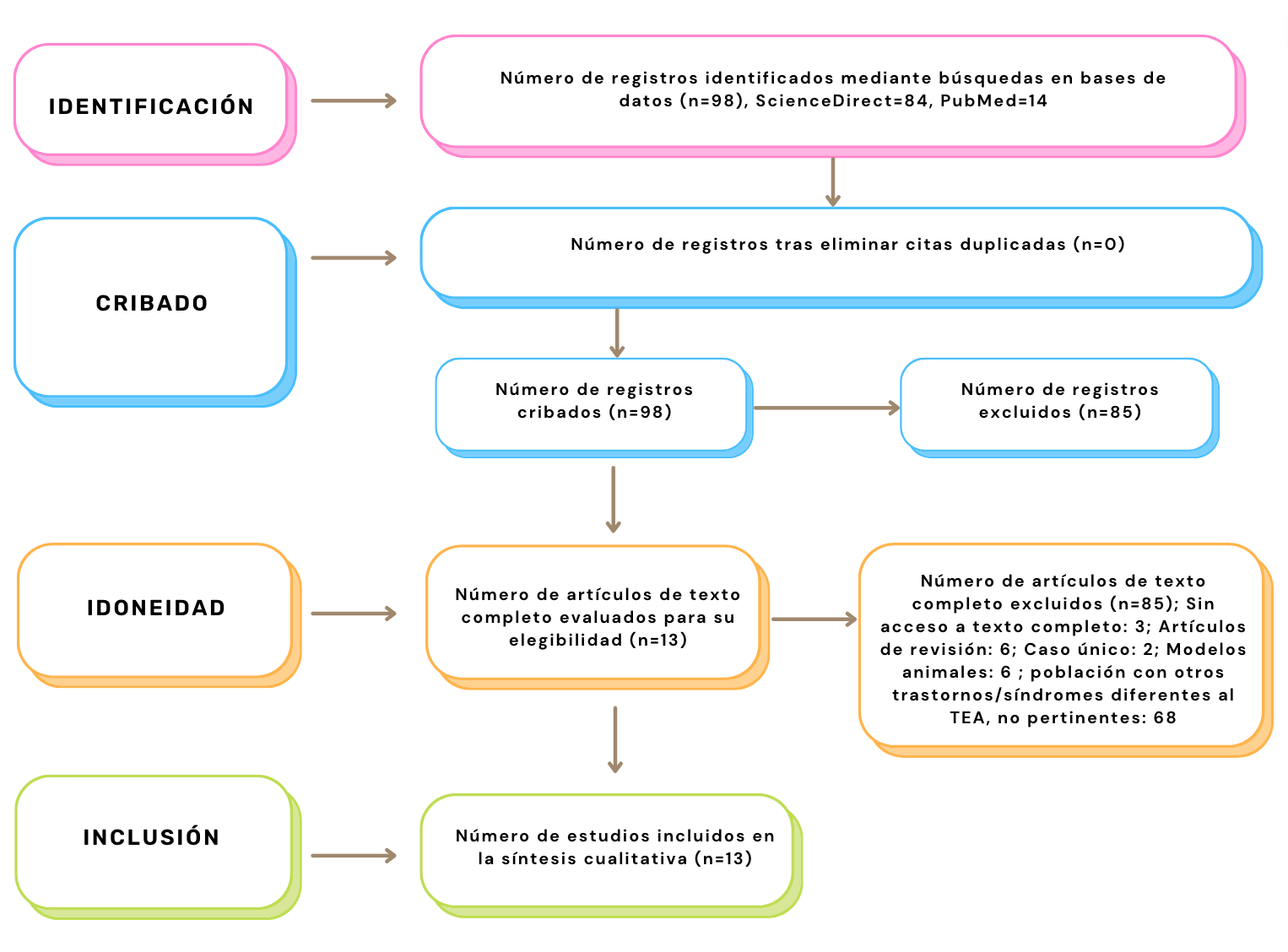
Figura 1. Diagrama de flujo PRISMA en sus cuatro niveles.
3. Resultados
3.1. Estrategia de selección
Con un total de 98 documentos identificados, no se encontraron duplicados. Un total de 85 artículos fueron excluidos leyendo los resúmenes por no cumplir con los criterios establecidos. Finalmente, 13 estudios fueron incluidos en esta revisión con la lectura del artículo completo.
3.2. Características de los estudios incluidos
Se plantearon tres objetivos para abordar diferentes aspectos de la relación entre el TEA y las alteraciones GI. El primero de ellos está relacionado con analizar la evidencia de los últimos cinco años en estudios con seres humanos diagnosticados con TEA y síntomas o alteraciones GI.28-31 Este objetivo se enfoca en revisar la literatura científica más reciente para comprender la relación entre el TEA y las alteraciones GI en seres humanos. El segundo objetivo tiene la finalidad de investigar la relación entre el TEA y la composición de la microbiota intestinal.32-34 Y el tercer objetivo corresponde a explorar la relación entre las intervenciones que apuntan a modificar algunos comportamientos asociados al TEA o mejorar síntomas GI, según la composición de la microbiota intestinal.35-40
De las investigaciones revisadas (Tabla 1), cuatro de ellas fueron incluidas por las características que asocian la presencia de síntomas, alteraciones o problemas GI con el TEA.28-31 Estos estudios utilizaron diferentes escalas y baterías para la evaluación o confirmación del diagnóstico de TEA, entre ellas: Autism Spectrum Quotient-10 (para adultos),28 Child Behaviour Checklist(CBCL),29 Autism Diagnostic Observation Schedule (ADOS),30,36,37Autism Behavior Checklist (ABC),31,32 Diagnostic and Statistical Manual, Fifth Edition diagnostic criterio,32,34 Autism Diagnostic Interview Revised (ADI-R)36Childhood Autism Rating Scale (CARS),33,35,39 Gilliam autism rating scale (GARS),39 Aberrant Behaviour Checklist-Community (ABC-C),39 ADOS Calibrated Severity Score (ADOS-CSS),40 Autism Treatment Evaluation Checklist (ATEC),40 entre otras.
Por el contrario, para la identificación de síntomas GI fueron utilizados los siguientes instrumentos: Gastrointestinal Symptom Inventory,28,29 Bovenschen´s gastrointestinal symptoms questionnaire,30 Brief Autism Mealtime Behavior Inventory (BAMBI) y Food Frequency Questionnaire (FFQ),31 por su historia clínica,34 Gastrointestinal Symptom Rating Scale (GSRS),35 Pediatric Quality of Life Inventory GI module (PedsQL),36 Rome III Version (QPGS-RIII),37 o Rome IV version,36,38 o Gastrointestinal Severity Index (GSI),40 evidenciando que no existe un consenso para el uso de un determinado instrumento/cuestionario de diagnóstico.
Las muestras de tres de los cuatro estudios mencionados estaban compuestas entre 46 a 107 participantes, siendo: 1) adultos28 (rango de edad 18-69 años), 2) niños y adolescentes29,30 (6-25 años), y 4) niños31 (conformado por dos grupos en rangos de edad de 2-5 años y 6-10 años). En los cuatro estudios las muestras de personas con TEA presentaron alteraciones GI, siendo el estreñimiento el más frecuente.28-31
En este reporte28 los autores exploraron en adultos con TEA la relación entre los problemas del sueño, los síntomas GI, así como el funcionamiento social, la calidad de vida, entre otros. Se reportó que el 86% de los participantes presentaron síntomas GI, siendo los más frecuentes la diarrea (61.7%), el dolor abdominal (54.2%), las náuseas e hinchazón (47.7%) y el estreñimiento (35.5%). No se encontró evidencia suficiente para relacionar si la presencia de estos síntomas está relacionada con la calidad de vida del paciente.
En otro reporte29 fue explorada la relación entre las personas diagnosticadas con TEA (n=95) que experimentaron problemas afectivos, síntomas GI, problemas de conducta (conducta desafiante) y problemas de sueño en una cohorte de niños y adolescentes. La correlación arrojó una relación positiva entre los problemas afectivos y las otras variables. También fue reportado que el 85% de los participantes tuvo un episodio o síntomas GI en los últimos 3 meses, y el 66% presentó más de un síntoma GI. El síntoma más común fue el estreñimiento, seguido de diarrea, dolor abdominal y náuseas.
Por otra parte, en un estudio adicional30 los resultados no concordaban con otros estudios analizados en esta revisión, donde se asoció que la microbiota intestinal en disbiosis no se correlacionó con síntomas GI en personas con TEA, pero sí con problemas de comportamiento/emocionales. En la metodología empleada se detalló que las alteraciones GI se evaluaron mediante un índice de gravedad GI, reportando sus síntomas GI y la frecuencia con la que éstos se producían en un lapso de cuatro semanas. Consideraron preguntas para identificar síntomas como: dolor abdominal, dolor epigástrico, la acidez estomacal, ruidos abdominales, distensión, “hábitos intestinales” comprendidos como una evacuación incompleta o evacuación con urgencia. Se reportó que los síntomas GI más frecuentes fueron la distensión abdominal, sensación de vacío y náuseas.
En otro estudio31 los autores investigaron el efecto de los hábitos alimenticios y el estado nutricional de niños con TEA, e indagaron sobre aspectos como clasificaciones del índice de masa corporal, hábitos alimenticios y problemas GI, en dos cohortes: un grupo de niños de 2-5 y 6-10 años. Se encontró que los problemas GI más frecuentes en estos niños fueron el estreñimiento, seguido de diarrea, y la presencia de gases. Los participantes presentaron hábitos alimenticios con una tendencia por seleccionar cierto tipo de alimentos. Además, la función de la masticación fue baja y, la deglución estuvo conservada en ambos grupos de edades.
Tabla 1. Características de los estudios revisados con relación al objetivo 1 del artículo.
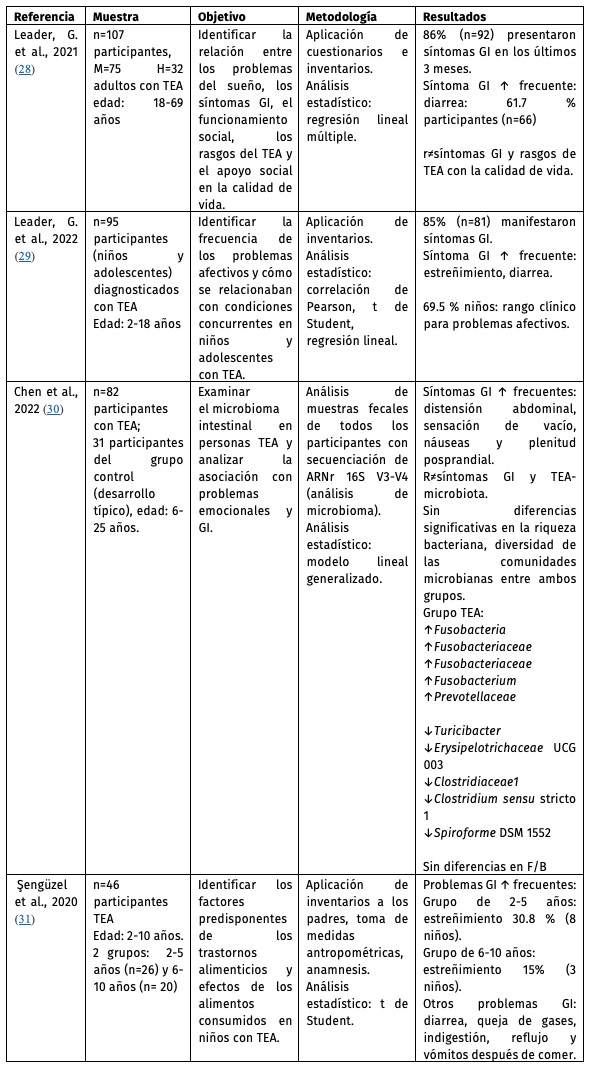
M: mujeres, H: hombres, TEA: Trastorno del Espectro Autista, GI: gastrointestinal, ARNr: ácido ribonucleico riboso-mal, ↑: más frecuente o incrementado, ↓: menos frecuente o decrementado, r+ correlación positiva, r≠ sin correla-ción, F/B: Firmicutes/ Bacteroidetes.
En cuanto al segundo objetivo de esta revisión, los reportes que asociaron el diagnóstico de TEA y la composición de la microbiota intestinal, en tres de los cuatro estudios se encontraron diferencias significativas en la composición del microbioma intestinal en personas con TEA32-34 comparado con el grupo control (Tabla 2).
En uno de los trabajos32 analizados para este objetivo se reportó que la prevalencia de bacterias del género Bifidobacterium estaba disminuida en personas con TEA. También, la proporción de Firmicutes/Bacteroidetes (F/B), en tres de los estudios analizados no reportaron diferencias en los grupos TEA en comparación con niños neurotípicos.30,33,34 Por el contrario, en otro estudio32 sí se reportaron diferencias significativas en la relación Firmicutes y Bacteroidetes (F/B) entre los grupos TEA y control, donde el grupo TEA presentó una menor proporción de estos microorganismos.
Otro grupo importante de bacterias a nivel de género es el Clostridium, donde tres de los cuatro estudios32-34 analizados presentaron una mayor abundancia de cepas de este género. Este tipo de bacteria puede producir neurotoxinas que ejercen un efecto sistémico en el ser humano, por lo que si se modula la microbiota intestinal reduciría esta bacteria, mejorando algunos síntomas del autismo.41
Tabla 2. Características de los estudios revisados con relación al objetivo 2 del artículo.
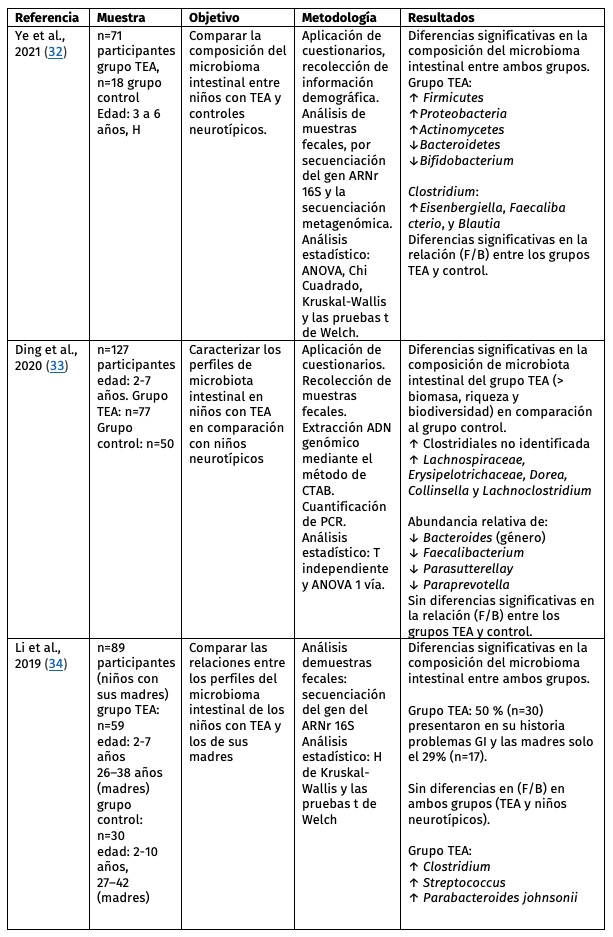
M: mujeres, H: hombres, TEA: Trastorno del Espectro Autista, GI: gastrointestinal, ARNr: ácido ribonucleico ribosomal, ↑: más frecuente o incrementado, ↓: menos frecuente o decrementado, r+ correlación positiva, r≠ sin correlación, CTAB: bromuro de cetiltrimetilamonio, F/B: proporción de Firmicutes/ Bacteroidetes
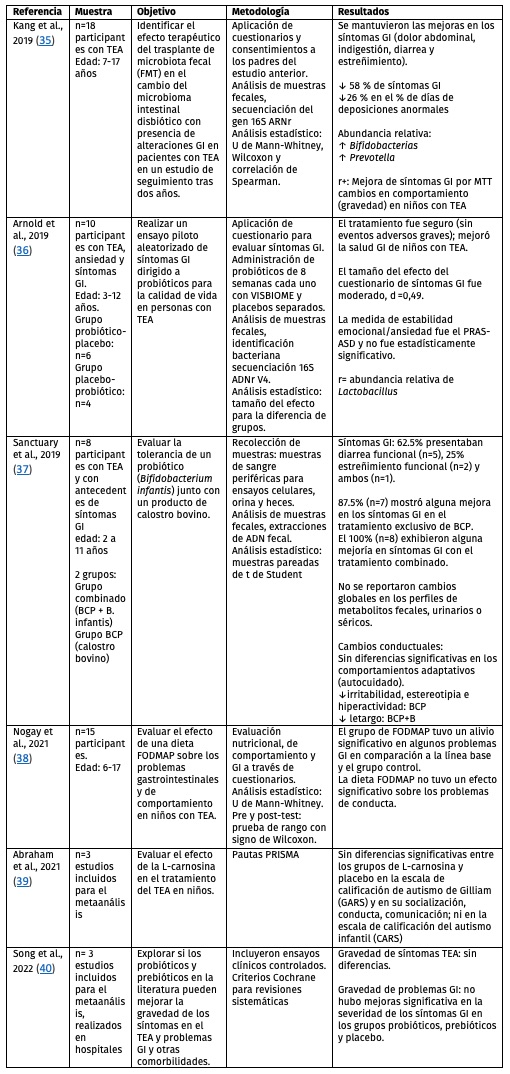
.Con relación al tercer objetivo, el cual corresponde a explorar las intervenciones enfocadas en modificar o paliar síntomas GI en personas con TEA se encontró que, en cuatro estudios de los cinco revisados para este objetivo, los síntomas GI mejoraron (Tabla 3). Estas intervenciones fueron por un tratamiento de trasplante fecal o MTT,35 por administración de probióticos,36,37 por el consumo de una dieta baja en FODMAP;38 así como, por la administración de suplementos dietéticos como L-carnosina.39
Por otra parte, como parte del tercer objetivo también se exploraron cuáles fueron las intervenciones que modificaron comportamientos asociados o característicos del TEA, encontrando que tres de los seis estudios revisados reportaron cambios en la conducta de los participantes autistas.35-37 En este estudio35 se reportó que la administración de la terapia de MTT propició cambios en la conducta presente en el TEA. Se encontró una asociación entre los cambios de comportamiento y la mejora de síntomas GI. En los estudios36,37 sí se reportaron cambios en el comportamiento, tales como: irritabilidad, estereotipias, hiperactividad y letargo. En otro estudio38 no se reportaron cambios en conductas autistas por administración de una dieta baja en FODMAP. En el metaanálisis39 no se reportaron cambios significativos en la conducta por la administración de L-Carnosina (un tipo de nutracéutico compuesto de ß-alanina y L-histidina). Por último, en otro metaanálisis40 tampoco se encontró evidencia para asociar la gravedad de síntomas TEA con el consumo de pre o probióticos.
Tabla 3. Características de los estudios revisados con relación al objetivo 3 del artículo.
4. Discusión
La información analizada con relación al primer objetivo de este trabajo señala que las personas diagnosticadas con TEA presentan alteraciones GI, siendo el estreñimiento el síntoma más frecuente,28-31 seguido de la diarrea.29,30,37 Esto coincide con el metaanálisis9 donde se reportó que el estreñimiento, diarrea y dolor abdominal fueron los trastornos GI más frecuentes. Además, los niños con TEA tenían hasta cuatro veces más probabilidades de desarrollar alteraciones GI en comparación con los niños de desarrollo neurotípico.
Se sabe que el estreñimiento per se no es una enfermedad, sin embargo, se considera una alteración GI muy frecuente y que, en algunos casos, resulta ser un síntoma principal para diagnosticar una enfermedad. El estreñimiento se puede definir como un trastorno del tracto GI, que resulta en la dificultad para defecar, acompañado de dolor y rigidez.41 El estreñimiento crónico se considera propiamente como una enfermedad GI. La etiología del estreñimiento ya sea como síntoma o alteración GI, responde a la desregulación de la actividad neuromuscular dentro del colon y del recto, que a veces se le suele llamar estreñimiento funcional.42 Se tiene que explorar en estudios preclínicos si la disbiosis de la microbiota GI propicia estos episodios de estreñimiento, como puede ocurrir a través de una señalización que altera a las neuronas y capas del SNE del colon.
Por otra parte, la mayoría de los estudios consultados para esta revisión no exploraron hábitos alimenticios al momento de evaluar variables asociadas a síntomas GI. Se ha reportado que los niños con autismo pueden presentar selectividad alimentaria;43,44 por ejemplo, hay una preferencia por alimentos de consistencia blanda como purés, teniendo un efecto directo sobre la calidad de la dieta, déficits nutrimentales e incluso dificultades motoras orales y disfagia.45
La etiología de estos síntomas GI suele apuntar a la disbiosis de la microbiota que parece estar implicada en la gravedad de las conductas de personas con TEA, es decir, que intensifican comportamientos como las estereotipias o la irritabilidad. Sin embargo, en los estudios analizados existe una heterogeneidad al momento de evaluar los síntomas o alteraciones gastrointestinales por la variabilidad de los instrumentos empleados en las entrevistas, así como las muestras de personas con TEA (por ejemplo, la cantidad de los participantes en las cohortes). También se debe señalar como limitación en esta revisión que no se tomó en cuenta la edad de los participantes al momento de elegir los criterios de inclusión, por lo que sólo un estudio fue realizado en adultos con autismo,28 los cuales presentaron una alta incidencia de síntomas GI.
De esta manera, se sugiere la creación de nuevas herramientas o el consenso de los criterios de diagnóstico para la evaluación de las alteraciones gastrointestinales, por ejemplo, como los criterios que propone Rome IV para diagnosticar trastornos o síntomas GI.
Con relación al segundo objetivo de esta revisión, que es la asociación entre los síntomas GI y la composición de microbiota intestinal, se encontró que la prevalencia del género Bifidobacterium estaba disminuida en personas con TEA.32 Estas bacterias, cuya ubicación principal es el intestino grueso, son parte de la microbiota intestinal y desempeñan un papel importante en la digestión de componentes no digeribles de los alimentos, como la fibra dietética, polisacáridos, oligosacáridos dietéticos complejos.46
De acuerdo con la propuesta de la biogeografía de las bacterias,47 en el ser humano se propone que la heterogeneidad bacteriana varía según su localización, encontrando cinco filos dominantes de bacterias: Bacteroidetes, Firmicutes, Actinobacteria, Proteobacteria y Verrucomicrobia. Estas difieren según la región del tracto intestinal en la que habitan, y por las condiciones fisiológicas del hábitat (acidez, pH, disponibilidad de nutrientes y concentración de oxígeno). Por lo tanto, es relevante considerar cuando un género específico de bacteria se encuentra en disbiosis, incrementada o disminuida, sea el caso, es por la participación que tiene en el correcto funcionamiento GI.
La literatura ya ha reportado estudios donde apunta que la microbiota intestinal está alterada en niños con autismo.48-50 Se ha encontrado que la microbiota de niños con TEA es menos diversa y presenta niveles bajos de Bifidobacterium y Firmicutes,46,49 así como niveles altos de Bacteroidetes, Lactobacillus, Clostridium. Asimismo, se ha reportado una menor abundancia de Prevotella, Coprococcus.48
Los dos filos bacterianos más importantes que predominan en la microbiota intestinal del ser humano, y constituyen alrededor del 90% de la población microbiana, son Firmicutes y Bacteroidetes (F/B). La relación F/B se suele reportar frecuentemente porque sirve como un cociente asociado de la presencia de estas bacterias con varias condiciones patológicas, entre ellas el autismo y la obesidad;51,52 seguidas por los filos Proteobacteria, Actinobacteria y Verrucomicrobia.53 Sin embargo, en tres de los cuatro estudios consultados, no se reportaron diferencias en los grupos TEA a nivel de proporción Firmicutes/Bacteroidetes,30,33,34 en contraste con la muestra de los participantes neurotípicos. Estos dos filos de bacterias son de los más abundantes en el intestino del ser humano, cumpliendo una función elemental como la de metabolizar los carbohidratos y ayudar a mantener el equilibrio del eje intestino-cerebro-microbiota.
Los niños con TEA, en comparación con niños neurotípicos, presentaron disbiosis en algunos grupos de bacterias del género Clostridium. Las Clostridium son conocidas por estar asociadas a la producción de neurotoxinas, ejerciendo efectos sistémicos o en sangre, así como una exacerbación de síntomas conductuales que justamente coinciden con problemas GI.54 Se ha postulado en algunos estudios que algunas bacterias, incluso levaduras, pueden producir ciertos neurotransmisores, tal es el caso de la serotonina producida por Streptococcus, Enterococcus y Candida55,56 o de GABA por las bacterias Lactobacillus y Bifidobacterium.57 Estos neurotransmisores pueden inducir la liberación de sustancias moduladoras de la señal del SNE, así como controlar funciones fisiológicas y la conducta a través del eje microbiota-intestino-cerebro.
En el estudio revisado,30 la prevalencia de las bacterias del filo Firmicutes y Clostridium se encontraban disminuidas. Estas bacterias fueron: Turicibacter, Erysipelotrichaceae UCG 003, Clostridiaceae 1, Clostridium sensu stricto 1 y Spiroforme DSM 1552. En otro estudio consultado34 tanto Clostridium y Streptococcus se encontraban incrementadas. Este tipo de bacterias no son invasivas; sin embargo, las toxinas que son secretadas por estas bacterias, a través de un mecanismo de señalización endocrino, logran atravesar la barrera intestinal y diseminarse a través de la circulación sanguínea hacia los órganos. La barrera intestinal funge como un sistema protector que se encuentra en el revestimiento del tracto gastrointestinal y cumple funciones como la absorción de nutrientes, regulación de la inmunidad y protección ante patógenos.58
En este estudio,33 se encontró que la prevalencia de Erysipelotrichaceae (del filo Firmicutes) fue mayor, mientras que Faecalibacterium (bacteria del orden Clostridiales) fue menor en una cohorte de niños con TEA grave en contraste con niños con TEA leve. La relevancia de estas dos cepas es que están relacionadas con la producción de metabolitos en el intestino, denominados ácido butírico y triptófano. El ácido butírico es un ácido de cadena corta, producto de la fermentación de carbohidratos y proteínas. Éste se encarga de la oxidación de ácidos grasos, así como estar relacionado con la función mitocondrial59 debido a su contribución a la fuente de energía de las células intestinales, su efecto benéfico en el epitelio intestinal se debe a que ejerce un efecto trófico y antiinflamatorio.60 Por otro lado, el triptófano es un aminoácido esencial, necesario para la producción de la serotonina.33 Con esto en mente, los niveles desregulados de ácido butírico y triptófano han sido asociados con la integridad de la barrera intestinal y la función inmune, correlacionado con la gravedad o intensificación de algunas manifestaciones del autismo.
Conforme a lo descrito anteriormente, tomando la literatura de referencia y estos resultados analizados, se destacan: la presencia de bacterias beneficiosas, como Bifidobacterium, y la abundancia de bacterias potencialmente perjudiciales, como Clostridium, que sugieren la posibilidad de disbiosis en algunas personas con TEA. Asimismo, algunas de las discrepancias en los resultados de estos estudios a nivel de F/B pueden deberse a varias razones, como diferencias en las poblaciones estudiadas, el tipo de dieta, ingesta de medicamentos impostergables, técnicas de secuenciación utilizadas, entre otros factores. Quedaría como sugerencia realizar una revisión a la par de la composición de grupos de bacterias y el metabolito al que se encuentra asociado para tener una comprensión más profunda del funcionamiento del eje microbiota-intestino-cerebro.
Sobre el tercer objetivo considerado en la presente revisión, la literatura reporta que el microbioma intestinal podría ser una potente diana terapéutica para paliar o mejorar la salud en personas con desórdenes neuropsiquiátricos o de neurodiversidad a través de la administración de pre y probióticos, modificaciones en su dieta e incluso intervenciones como el trasplante de microbiota fecal.
Con relación al trasplante de microbiota fecal, en Canadá y USA este procedimiento está regulado por ser considerado un “medicamento biológico”,61,62 el cual consiste en que se toman ciertas bacterias saludables (microbiota) de las heces de un donante que fue seleccionado previamente y luego, se transfieren al colon del receptor a través de una colonoscopia o una endoscopia digestiva alta.63 El estudio revisado que realizó el procedimiento llamado MTT35 consistió en el cambio del microbioma intestinal disbiótico, con antecedentes de alteraciones GI, en un grupo de pacientes con TEA. Como resultado, estos pacientes mostraron una mejoría en los síntomas GI, tales como: dolor abdominal, indigestión, diarrea y estreñimiento. Asimismo, en este estudio se observó un incremento de Bifidobacterias y Prevotella tras el MTT.
Por un estudio anterior,48 se dio a conocer que la Prevotella fue menos abundante en las heces de niños con TEA en comparación con niños neurotípicos. La Prevotella está implicada en la síntesis de butirato. Como se mencionó anteriormente,59,60 el butirato o ácido butírico es un ácido graso de cadena corta que desempeña un papel importante en la salud intestinal, incluyendo la regulación de la inmunidad intestinal.48 Es una fuente de energía para las células del colon64 y tiene propiedades antiinflamatorias. En el estudio analizado para esta revisión,35 que resultó ser un estudio de seguimiento, también se reportó que la Prevotella se encontraba incrementada y los síntomas relacionados con el autismo mejoraron aún más después de finalizar el tratamiento.
Otra intervención importante también es la nutrimental. En esta revisión se encontró que, en un estudio36 sobre suplementación con probióticos que contenían Lactobacillus y Bifidobacterium encontraron que el tratamiento brindó una mejora en la salud GI de niños con TEA.
En otro estudio,37 se evaluó la tolerabilidad de un probiótico que contenía Bifidobacterium infantis y calostro bovino (BCP) en una muestra de individuos con TEA que también tenían problemas GI. Uno de los resultados reportados fue el efecto favorable sobre los problemas GI: el probiótico que contenía Bifidobacterium infantis y calostro bovino resultó en un efecto positivo sobre los problemas gastrointestinales en la muestra de individuos con TEA. Esto sugiere que el probiótico podría tener un impacto beneficioso en la salud gastrointestinal de este grupo de pacientes. Aunque el probiótico fue bien tolerado en general, se informó la presencia de gases leves como un efecto secundario. Las flatulencias o la presencia de gases es un efecto común asociado con la toma de probióticos en algunas personas y, por lo general, no se considera un efecto adverso grave. En este estudio también se reportaron cambios conductuales en el grupo de tratamiento sólo con BCP. Se reportó una reducción significativa en ciertos comportamientos aberrantes según el cuestionario ABC, que incluyeron reducción de la irritabilidad, estereotipias e hiperactividad. Estos resultados sugieren que el tratamiento con BCP podría tener un impacto positivo en la conducta de los individuos con TEA.
En el estudio38 se administró una dieta baja en FODMAP a individuos con TEA y se reportó que hubo un alivio significativo en problemas GI. Esto sugiere que la reducción de ciertos carbohidratos fermentables en la dieta, que pueden provocar la producción de gases y distensión abdominal, puede ayudar a mejorar los síntomas GI en personas con TEA que presentan problemas GI. Se sabe que una causa probable de la fermentación de la FODMAP es por las bacterias intestinales. Estas bacterias al inducir un proceso de fermentación generan una mayor producción de gases, por ejemplo, mayor producción de dióxido de carbono y de metano, generando distensión abdominal y, por tanto, flatulencias.65
Aunque la dieta baja en FODMAP tuvo un impacto positivo en los síntomas gastrointestinales, no se observaron mejoras significativas en los problemas de conducta en la muestra estudiada. Esto sugiere que, al menos en este grupo, la dieta no influyó de manera significativa en los comportamientos relacionados con el TEA. De este ensayo clínico, se pude destacar que como limitaciones tiene el tamaño de la muestra y la variabilidad individual en la respuesta a las intervenciones, por lo que no resulta válido hacer generalizaciones amplias.
También, en el metaanálisis de ensayos controlados aleatorios revisado39, se reportó que en tres de los cinco estudios analizados no encontraron diferencias significativas entre los grupos de L-carnosina y placebo según la escala de calificación de autismo de Gilliam (Gilliam autism rating scale-GARS). Dicha escala contiene tres subescalas que son: de conducta, comunicación y socialización. Se reportaron algunas modificaciones en la mejora de síntomas TEA, a dosis recomendadas de L-carnosina como 800 mg, 500 mg, 10-15 mg/kg, presentando hiperactividad debida a un tratamiento combinado de L-carnosina y risperidona.
Por otra parte, otro metaanálisis revisado40 reportó que no se encontraron diferencias en los ensayos clínicos donde los probióticos y los prebióticos administrados no mejoraron la gravedad de los pacientes con TEA, ni sus síntomas GI. Cabe señalar que estos estudios tienen una principal diferencia, como el período en el cual se administraron los prebióticos y probióticos porque difieren entre ellos (uno fue por un mes, otro por tres meses y medio y, el más largo por seis meses). Esta heterogeneidad de duración de los tratamientos también pudo contribuir a los resultados presentados.
Toda esta información muestra que las alteraciones en la microbiota intestinal o una disbiosis son heterogéneas en las personas con autismo.30 Estas diferencias podrían deberse a cuestiones metodológicas en los grupos de los estudios: rangos de edades, hábitos alimenticios que varían por la cultura, países de origen, estilos de vida, etc. Y si bien es cierto, un perfil bacteriano es único en cada sujeto, varía en una misma persona por diversos componentes como: cambios ambientales, hábitos de alimentación, edad, etc.
De los seis estudios revisados, tres35,37,39 sugieren una relación entre los síntomas GI en personas con TEA y la mejora en la gravedad de ciertos comportamientos, como estereotipias, irritabilidad e hiperactividad, que resultan importantes en la comprensión de la interacción entre la microbiota intestinal, el sistema gastrointestinal y el sistema nervioso en individuos con TEA. Esta evidencia sugiere que la microbiota intestinal puede influir en la función del SNC a través de la comunicación del eje microbiota-intestino-cerebro. Por otra parte, los cambios en la composición y actividad de la microbiota intestinal pueden afectar la producción de neurotransmisores y compuestos que influyen en el estado emocional y el comportamiento. Esto podría explicar por qué la mejora de algunas alteraciones gastrointestinales se asocia a veces con una reducción en la gravedad de ciertos comportamientos en personas con TEA.
Toda esta información aquí expuesta sobre la relación entre los microorganismos intestinales y la gravedad de los síntomas del TEA sugiere que la microbiota podría servir como un indicador biológico para el agravamiento de los síntomas. Esto tiene el potencial de llevar a enfoques terapéuticos que se centran en la modulación de la microbiota intestinal para mejorar la calidad de vida de las personas con TEA.
5. Conclusión
Los resultados analizados en esta revisión indi-can que sí existe una relación entre las alteracio-nes o síntomas GI, y en algunas personas con TEA. También estos resultados apuntan a que sí hay una asociación entre la disbiosis de la micro-biota intestinal y estas alteraciones GI en indivi-duos con TEA. Las conclusiones se pueden agrupar según los tres objetivos propuestos para esta revisión. La primera sería sobre la relación entre altera-ciones GI y TEA: los síntomas o alteraciones GI tienen una comorbilidad con el diagnóstico de autismo o personas que tienen TEA, resultando en ser una preocupación importante en esta población. La segunda sería sobre la relación entre el au-tismo y la composición de la microbiota intesti-nal. Se ha observado que las personas con TEA presentan una composición disbiótica de la mi-crobiota intestinal, junto con una actividad alte-rada. Esto significa que hay cambios en la com-posición y el funcionamiento de la microbiota intestinal en individuos con TEA en comparación con personas neurotípicas. Y finalmente, la tercera sería sobre la relación entre las intervenciones que apuntan a modificar algunos comportamientos asociados al TEA (tales como estereotipias, irritabilidad) o mejo-rar síntomas GI, según la composición de la mi-crobiota intestinal. Se reportó que las interven-ciones a través de suplementos como probióti-cos, tipos de dieta o trasplante de microbiota fecal pueden aliviar las alteraciones GI en perso-nas con TEA. Además, se analizó la evidencia de que estas intervenciones pueden modificar la gravedad de comportamientos como las este-reotipias, hiperactividad o la irritabilidad en indi-viduos con TEA.
6. Agradecimientos
Se agradece al Consejo Nacional de Humanida-des, Ciencias y Tecnologías (CONAHCyT) de México por el apoyo otorgado a través del Pro-grama de Becas Nacionales a FMJCS (No. CVU: 1036810), al Instituto de Investigaciones Cere-brales (IICE) de la Universidad Veracruzana, así como a la asociación peruana Liceo Contextual.
7. Conflicto de intereses
Los autores declaran no tener conflicto de intereses en la publicación del artículo.
8. References
- Manual Diagnóstico y Estadístico de los Trastornos Mentales DSM-5-TR. (2014). Masson.
- Goldani, A. A. S., Downs, S. R., Widjaja, F., Lawton, B., & Hendren, R. L. (2014). Biomarkers in Autism. Frontiers in psychiatry, 5,100. https://doi.org/10.3389/fpsyt.2014.00100
- Chaste, P., & Leboyer, M. (2012). Autism risk factors: genes, environment, and gene-environment interactions. Dialogues in clinical neuroscience, 14(3), 281–292. https://doi.org/10.31887/DCNS.2012.14.3/pchaste
- Bjørklund, G., Meguid, N. A., El-Bana, M. A., Tinkov, A. A., Saad, K., Dadar, M., Hemimi, M., Skalny, A. V., Hosnedlová, B., Kizek, R., Osredkar, J., Urbina, M. A., Fabjan, T., El-Houfey, A. A., Kałużna-Czaplińska, J., Gątarek, P., & Chirumbolo, S. (2020). Oxidative stress in autism spectrum disorder. Molecular Neurobiology, 57(5), 2314–2332.https://doi.org/10.1007/s12035-019-01742-
- Díaz-Anzaldúa, A., & Díaz-Martínez, A. (2013). Contribución genética, ambiental y epigenética en la susceptibilidad a los trastornos del espectro autista [Genetic, environmental, and epigenetic contribution to the susceptibility to autism spectrum disorders]. Revista de neurologia, 57(12), 556–568.
- Bhat, S., Acharya, U. R., Adeli, H., Bairy, G. M., & Adeli, A. (2014). Autism: cause factors, early diagnosis and therapies. Reviews in the neurosciences, 25(6). https://doi.org/10.1515/revneuro-2014-0056
- Matsuzaki, H., Iwata, K., Manabe, T., & Mori, N. (2012). Triggers for autism: Genetic and environmental factors. Journal of Central Nervous System Disease, 4, JCNSD.S9058. https://doi.org/10.4137/jcnsd.s9058
- Christensen, J., Grønborg, T. K., Sørensen, M. J., Schendel, D., Parner, E. T., Pedersen, L. H., & Vestergaard, M. (2013). Prenatal valproate exposure and risk of autism spectrum disorders and childhood autism. JAMA: The Journal of the American Medical Association, 309(16), 1696. https://doi.org/10.1001/jama.2013.2270
- McElhanon, B. O., McCracken, C., Karpen, S., & Sharp, W. G. (2014). Gastrointestinal symptoms in autism spectrum disorder: A meta-analysis. Pediatrics, 133(5), 872–883. https://doi.org/10.1542/peds.2013-3995
- Penzol, M. J., Salazar de Pablo, G., Llorente, C., Moreno, C., Hernández, P., Dorado, M. L., & Parellada, M. (2019). Functional Gastrointestinal Disease in Autism Spectrum Disorder: A Retrospective Descriptive Study in a Clinical Sample. Frontiers in psychiatry, 10, 179. https://doi.org/10.3389/fpsyt.2019.00179
- Bernier, R., Golzio, C., Xiong, B., Stessman, H. A., Coe, B. P., Penn, O., Witherspoon, K., Gerdts, J., Baker, C., Vulto-van Silfhout, A. T., Schuurs-Hoeijmakers, J. H., Fichera, M., Bosco, P., Buono, S., Alberti, A., Failla, P., Peeters, H., Steyaert, J., Vissers, L. E. L. M., … Eichler, E. E. (2014). Disruptive CHD8 mutations define a subtype of autism early in development. Cell, 158(2), 263–276. https://doi.org/10.1016/j.cell.2014.06.017
- Chaidez, V., Hansen, R. L., & Hertz-Picciotto, I. (2014). Gastrointestinal problems in children with autism, developmental delays or typical development. Journal of autism and developmental disorders, 44(5), 1117–1127. https://doi.org/10.1007/s10803-013-1973-x
- Holingue, C., Newill, C., Lee, L.-C., Pasricha, P. J., & Daniele Fallin, M. (2018). Gastrointestinal symptoms in autism spectrum disorder: A review of the literature on ascertainment and prevalence: Gastrointestinal Symptoms in Autism Spectrum Disorder. Autism Research: Official Journal of the International Society for Autism Research, 11(1), 24–36. https://doi.org/10.1002/aur.1854
- ohnson, A. C., Louwies, T., Yuan, T., Orock, A., & Greenwood-Van Meerveld, B. (2020). Gut and brain interactions. En Clinical and Basic Neurogastroenterology and Motility. Elsevier.
- Mohajeri, M. H., La Fata, G., Steinert, R. E., & Weber, P. (2018). Relationship between the gut microbiome and brain function. Nutrition Reviews, 76(7), 481–496. https://doi.org/10.1093/nutrit/nuy009
- Góralczyk-Bińkowska, A., Szmajda-Krygier, D., & Kozłowska, E. (2022). The Microbiota-Gut-Brain Axis in Psychiatric Disorders. International journal of molecular sciences, 23(19), 11245. https://doi.org/10.3390/ijms231911245
- Doroszkiewicz, J., Groblewska, M., & Mroczko, B. (2021). The Role of Gut Microbiota and Gut-Brain Interplay in Selected Diseases of the Central Nervous System. International journal of molecular sciences, 22(18), 10028. https://doi.org/10.3390/ijms221810028
- De Angelis, M., Francavilla, R., Piccolo, M., De Giacomo, A., & Gobbetti, M. (2015). Autism spectrum disorders and intestinal microbiota. Gut microbes, 6(3), 207–213. https://doi.org/10.1080/19490976.2015.1035855
- Socała, K., Doboszewska, U., Szopa, A., Serefko, A., Włodarczyk, M., Zielińska, A., Poleszak, E., Fichna, J., & Wlaź, P. (2021). The role of microbiota-gut-brain axis in neuropsychiatric and neurological disorders. Pharmacological Research: The Official Journal of the Italian Pharmacological Society, 172(105840), 105840. https://doi.org/10.1016/j.phrs.2021.105840
- Matta, S. M., Hill-Yardin, E. L., & Crack, P. J. (2019). The influence of neuroinflammation in Autism Spectrum Disorder. Brain, Behavior, and Immunity, 79, 75–90. https://doi.org/10.1016/j.bbi.2019.04.037
- Xu, M., Xu, X., Li, J., & Li, F. (2019). Association between gut Microbiota and autism spectrum disorder: A systematic review and meta-analysis. Frontiers in psychiatry, 10. https://doi.org/10.3389/fpsyt.2019.00473
- Li, Q., Han, Y., Dy, A. B. C., & Hagerman, R. J. (2017). The gut Microbiota and autism spectrum disorders. Frontiers in cellular neuroscience, 11. https://doi.org/10.3389/fncel.2017.00120
- Luna, R. A., Oezguen, N., Balderas, M., Venkatachalam, A., Runge, J. K., Versalovic, J., Veenstra-VanderWeele, J., Anderson, G. M., Savidge, T., & Williams, K. C. (2017). Distinct microbiome-neuroimmune signatures correlate with functional abdominal pain in children with autism spectrum disorder. Cellular and Molecular Gastroenterology and Hepatology, 3(2), 218–230. https://doi.org/10.1016/j.jcmgh.2016.11.008
- Quigley, E. M. M. (2016). Leaky gut – concept or clinical entity? Current Opinion in Gastroenterology, 32(2), 74–79. https://doi.org/10.1097/mog.0000000000000243
- Garcia-Gutierrez, E., Narbad, A., & Rodríguez, J. M. (2020). Autism spectrum disorder associated with gut Microbiota at immune, metabolomic, and neuroactive level. Frontiers in neuroscience, 14. https://doi.org/10.3389/fnins.2020.578666
- Sandler, R. H., Finegold, S. M., Bolte, E. R., Buchanan, C. P., Maxwell, A. P., Väisänen, M.-L., Nelson, M. N., & Wexler, H. M. (2000). Short-term benefit from oral vancomycin treatment of regressive-onset autism. Journal of Child Neurology, 15(7), 429–435. https://doi.org/10.1177/088307380001500701
- Kang, D. W., Adams, J. B., Gregory, A. C., Borody, T., Chittick, L., Fasano, A., Khoruts, A., Geis, E., Maldonado, J., McDonough-Means, S., Pollard, E. L., Roux, S., Sadowsky, M. J., Lipson, K. S., Sullivan, M. B., Caporaso, J. G., & Krajmalnik-Brown, R. (2017). Microbiota Transfer Therapy alters gut ecosystem and improves gastrointestinal and autism symptoms: an open-label study. Microbiome, 5(1), 10. https://doi.org/10.1186/s40168-016-0225-7
- Leader, G., Barrett, A., Ferrari, C., Casburn, M., Maher, L., Naughton, K., Arndt, S., & Mannion, A. (2021). Quality of life, gastrointestinal symptoms, sleep problems, social support, and social functioning in adults with autism spectrum disorder. Research in Developmental Disabilities, 112(103915), 103915. https://doi.org/10.1016/j.ridd.2021.103915
- Leader, G., Browne, H., Whelan, S., Cummins, H., & Mannion, A. (2022). Affective problems, gastrointestinal symptoms, sleep problems, and challenging behaviour in children and adolescents with autism spectrum disorder. Research in Autism Spectrum Disorders, 92(101915), 101915. https://doi.org/10.1016/j.rasd.2022.101915
- Chen, Y.-C., Lin, H.-Y., Chien, Y., Tung, Y.-H., Ni, Y.-H., & Gau, S. S.-F. (2022). Altered gut microbiota correlates with behavioral problems but not gastrointestinal symptoms in individuals with autism. Brain, Behavior, and Immunity, 106, 161–178. https://doi.org/10.1016/j.bbi.2022.08.015
- Şengüzel, S., Cebeci, A. N., Ekici, B., Gönen, İ., & Tatlı, B. (2021). Impact of eating habits and nutritional status on children with autism spectrum disorder. Journal of Taibah University Medical Sciences, 16(3), 413–421. https://doi.org/10.1016/j.jtumed.2020.11.010
- Ye, F., Gao, X., Wang, Z., Cao, S., Liang, G., He, D., Lv, Z., Wang, L., Xu, P., & Zhang, Q. (2021). Comparison of gut microbiota in autism spectrum disorders and neurotypical boys in China: A case-control study. Synthetic and Systems Biotechnology, 6(2), 120–126. https://doi.org/10.1016/j.synbio.2021.03.003
- Ding, X., Xu, Y., Zhang, X., Zhang, L., Duan, G., Song, C., Li, Z., Yang, Y., Wang, Y., Wang, X., & Zhu, C. (2020). Gut microbiota changes in patients with autism spectrum disorders. Journal of Psychiatric Research, 129, 149–159. https://doi.org/10.1016/j.jpsychires.2020.06.032
- Li, N., Yang, J., Zhang, J., Liang, C., Wang, Y., Chen, B., Zhao, C., Wang, J., Zhang, G., Zhao, D., Liu, Y., Zhang, L., Yang, J., Li, G., Gai, Z., Zhang, L., & Zhao, G. (2019). Correlation of gut microbiome between ASD children and mothers and potential biomarkers for risk assessment. Genomics, Proteomics & Bioinformatics, 17(1), 26–38. https://doi.org/10.1016/j.gpb.2019.01.002
- Kang, D.-W., Adams, J. B., Coleman, D. M., Pollard, E. L., Maldonado, J., McDonough-Means, S., Caporaso, J. G., & Krajmalnik-Brown, R. (2019). Long-term benefit of Microbiota Transfer Therapy on autism symptoms and gut microbiota. Scientific Reports, 9(1), 5821. https://doi.org/10.1038/s41598-019-42183-0
- Arnold, L. E., Luna, R. A., Williams, K., Chan, J., Parker, R. A., Wu, Q., Hollway, J. A., Jeffs, A., Lu, F., Coury, D. L., Hayes, C., & Savidge, T. (2019). Probiotics for gastrointestinal symptoms and quality of life in autism: A placebo-controlled pilot trial. Journal of Child and Adolescent Psychopharmacology, 29(9), 659–669. https://doi.org/10.1089/cap.2018.0156
- Sanctuary, M. R., Kain, J. N., Chen, S. Y., Kalanetra, K., Lemay, D. G., Rose, D. R., Yang, H. T., Tancredi, D. J., German, J. B., Slupsky, C. M., Ashwood, P., Mills, D. A., Smilowitz, J. T., & Angkustsiri, K. (2019). Pilot study of probiotic/colostrum supplementation on gut function in children with autism and gastrointestinal symptoms. PloS One, 14(1), e0210064. https://doi.org/10.1371/journal.pone.0210064
- Nogay, N. H., Walton, J., Roberts, K. M., Nahikian-Nelms, M., & Witwer, A. N. (2021). The effect of the low FODMAP diet on gastrointestinal symptoms, behavioral problems and nutrient intake in children with autism spectrum disorder: A randomized controlled pilot trial. Journal of Autism and Developmental Disorders, 51(8), 2800–2811. https://doi.org/10.1007/s10803-020-04717-8
- Abraham, D. A., Undela, K., Narasimhan, U., & Rajanandh, M. G. (2021). Effect of L-Carnosine in children with autism spectrum disorders: a systematic review and meta-analysis of randomised controlled trials. Amino Acids, 53(4), 575–585. https://doi.org/10.1007/s00726-021-02960-6
- Song, W., Zhang, M., Teng, L., Wang, Y., & Zhu, L. (2022). Prebiotics and probiotics for autism spectrum disorder: a systematic review and meta-analysis of controlled clinical trials. Journal of Medical Microbiology, 71(4). https://doi.org/10.1099/jmm.0.001510
- Forootan, M., Bagheri, N., & Darvishi, M. (2018). Chronic constipation: A review of literature. Medicine, 97(20), e10631. https://doi.org/10.1097/md.0000000000010631
- Sharma, A., & Rao, S. (2016). Constipation: Pathophysiology and current therapeutic approaches. En Gastrointestinal Pharmacology (pp. 59–74). Springer International Publishing. https://doi.org/10.1007/164_2016_111
- Cermak, S. A., Curtin, C., & Bandini, L. G. (2010). Food selectivity and sensory sensitivity in children with autism spectrum disorders. Journal of the American Dietetic Association, 110(2), 238–246. https://doi.org/10.1016/j.jada.2009.10.032
- Esposito, M., Mirizzi, P., Fadda, R., Pirollo, C., Ricciardi, O., Mazza, M., & Valenti, M. (2023). Food selectivity in children with autism: Guidelines for assessment and clinical interventions. International Journal of Environmental Research and Public Health, 20(6), 5092. https://doi.org/10.3390/ijerph20065092
- Viviers, M., Jongh, M., Dickonson, L., Malan, R., & Pike, T. (2020). Parent-reported feeding and swallowing difficulties of children with Autism Spectrum Disorders (aged 3 to 5 years) compared to typically developing peers: a South African study. African health sciences, 20(1), 524–532. https://doi.org/10.4314/ahs.v20i1.59
- Luo, J., Li, Y., Xie, J., Gao, L., Liu, L., Ou, S., Chen, L., & Peng, X. (2018). The primary biological network of Bifidobacterium in the gut. FEMS Microbiology Letters, 365(8). https://doi.org/10.1093/femsle/fny057
- Donaldson, G. P., Lee, S. M., & Mazmanian, S. K. (2016). Gut biogeography of the bacterial microbiota. Nature Reviews. Microbiology, 14(1), 20–32. https://doi.org/10.1038/nrmicro3552
- Kang, D.-W., Park, J. G., Ilhan, Z. E., Wallstrom, G., Labaer, J., Adams, J. B., & Krajmalnik-Brown, R. (2013). Reduced incidence of Prevotella and other fermenters in intestinal microflora of autistic children. PloS One, 8(7), e68322. https://doi.org/10.1371/journal.pone.0068322
- Tomova, A., Husarova, V., Lakatosova, S., Bakos, J., Vlkova, B., Babinska, K., & Ostatnikova, D. (2015). Gastrointestinal microbiota in children with autism in Slovakia. Physiology & behavior, 138, 179–187. https://doi.org/10.1016/j.physbeh.2014.10.033
- De Angelis, M., Piccolo, M., Vannini, L., Siragusa, S., De Giacomo, A., Serrazzanetti, D. I., Cristofori, F., Guerzoni, M. E., Gobbetti, M., & Francavilla, R. (2013). Fecal Microbiota and metabolome of children with autism and pervasive developmental disorder not otherwise specified. PloS One, 8(10), e76993. https://doi.org/10.1371/journal.pone.0076993
- Rinninella, E., Raoul, P., Cintoni, M., Franceschi, F., Miggiano, G., Gasbarrini, A., & Mele, M. (2019). What is the healthy gut Microbiota composition? A changing ecosystem across age, environment, diet, and diseases. Microorganisms, 7(1), 14. https://doi.org/10.3390/microorganisms7010014
- Magne, F., Gotteland, M., Gauthier, L., Zazueta, A., Pesoa, S., Navarrete, P., & Balamurugan, R. (2020). The Firmicutes/Bacteroidetes ratio: A relevant marker of gut dysbiosis in obese patients? Nutrients, 12(5), 1474. https://doi.org/10.3390/nu12051474
- Qin, J., MetaHIT Consortium, Li, R., Raes, J., Arumugam, M., Burgdorf, K. S., Manichanh, C., Nielsen, T., Pons, N., Levenez, F., Yamada, T., Mende, D. R., Li, J., Xu, J., Li, S., Li, D., Cao, J., Wang, B., Liang, H., … Wang, J. (2010). A human gut microbial gene catalogue established by metagenomic sequencing. Nature, 464(7285), 59–65. https://doi.org/10.1038/nature08821
- Parracho, H. M., Bingham, M. O., Gibson, G. R., & McCartney, A. L. (2005). Differences between the gut microflora of children with autistic spectrum disorders and that of healthy children. Journal of Medical Microbiology, 54(Pt 10), 987–991. https://doi.org/10.1099/jmm.0.46101-0
- Stefano, G. B., Pilonis, N., Ptacek, R., Raboch, J., Vnukova, M., & Kream, R. M. (2018). Gut, microbiome, and brain regulatory axis: Relevance to neurodegenerative and psychiatric disorders. Cellular and Molecular Neurobiology, 38(6), 1197–1206. https://doi.org/10.1007/s10571-018-0589-2
- Dicks, L. M. T. (2022). Gut bacteria and neurotransmitters. Microorganisms, 10(9), 1838. https://doi.org/10.3390/microorganisms10091838
- Barrett, E., Ross, R. P., O’Toole, P. W., Fitzgerald, G. F., & Stanton, C. (2012). γ-Aminobutyric acid production by culturable bacteria from the human intestine. Journal of Applied Microbiology, 113(2), 411–417. https://doi.org/10.1111/j.1365-2672.2012.05344.x
- Celebi Sözener, Z., Cevhertas, L., Nadeau, K., Akdis, M., & Akdis, C. A. (2020). Environmental factors in epithelial barrier dysfunction. The Journal of allergy and clinical immunology, 145(6), 1517–1528. https://doi.org/10.1016/j.jaci.2020.04.024
- Li, X., Li, R., You, N., Zhao, X., Li, J., & Jiang, W. (2022). Butyric Acid Ameliorates Myocardial Fibrosis by Regulating M1/M2 Polarization of Macrophages and Promoting Recovery of Mitochondrial Function. Frontiers in nutrition, 9, 875473. https://doi.org/10.3389/fnut.2022.875473
- Manrique Vergara, D., & González Sánchez, M. E. (2017). Ácidos grasos de cadena corta (ácido butírico) y patologías intestinales [Short chain fatty acids (butyric acid) and intestinal diseases]. Nutricion hospitalaria, 34(Suppl 4), 58–61. https://doi.org/10.20960/nh.1573
- Health Canada (2015). Guidance Document: Fecal Microbiota Therapy Used in the Treatment of Clostridium difficile Infections. Health Canada.
- Draft Guidance for Industry: Enforcement Policy Regarding Investigational New Drug Requirements for Use of Fecal Microbiota for Transplantation to Treat Clostridium difficile Infection Not Responsive to Standard Therapies. (2014). US Food and Drug Administration.
- Gupta, S., Allen-Vercoe, E., & Petrof, E. O. (2016). Fecal microbiota transplantation: in perspective. Therapeutic Advances in Gastroenterology, 9(2), 229–239. https://doi.org/10.1177/1756283X15607414
- Donohoe, D. R., Garge, N., Zhang, X., Sun, W., O’Connell, T. M., Bunger, M. K., & Bultman, S. J. (2011). The microbiome and butyrate regulate energy metabolism and autophagy in the mammalian colon. Cell metabolism, 13(5), 517–526. https://doi.org/10.1016/j.cmet.2011.02.018
- Hill, P., Muir, J. G., & Gibson, P. R. (2017). Controversies and recent developments of the low-FODMAP diet. Gastroenterology & Hepatology, 13(1), 36–45.
| Recibido: 31 de agosto, 2023 | Aceptado: 2 de diciembre, 2023 |
Caycho-Salazar, Flower de María de Jesús. Doctorado en Investigaciones Cerebrales. Universidad Veracruzana. Xalapa, Ver. México. C.P. 91010, Tel: 52 (241) 1796556. E-mail: flower.casal@gmail.com
Este es un artículo de libre acceso distribuido bajo los términos de la licencia de Creative Commons, (http://creamasal@unam.mxtivecommons.org/licenses/by-nc/3.0), que permite el uso no comercial, distribución y reproducción en algún medio, siempre que la obra original sea debidamente citada.
